Você já presenciou o impacto devastador de uma geada em sua lavoura, transformando uma promissora safra em prejuízos milionários da noite para o dia? O estresse por baixas temperaturas representa um dos principais desafios climáticos enfrentados pelo agronegócio brasileiro, especialmente nas regiões Sul e Sudeste, onde eventos de geada podem causar perdas de produtividade que chegam a 38,6% em culturas como arroz, e prejuízos econômicos superiores a R$ 2 bilhões anuais1.
A crioproteção vegetal – conjunto de mecanismos que as plantas desenvolveram para sobreviver e prosperar sob baixas temperaturas – não é apenas uma curiosidade fisiológica, mas uma tecnologia natural sofisticada que determina a viabilidade econômica de milhões de hectares cultivados no Brasil. Diferentemente do estresse térmico por calor, o frio apresenta desafios únicos: formação de cristais de gelo intracelulares, ruptura de membranas, colapso do sistema vascular e interrupção completa da fotossíntese.
No contexto da agricultura brasileira, onde culturas como trigo, aveia, cevada e até mesmo soja em plantios tardios enfrentam temperaturas próximas ou abaixo de 0°C, compreender os mecanismos de crioproteção torna-se fundamental para a sustentabilidade produtiva. Este artigo apresentará uma análise técnica abrangente dos processos moleculares, bioquímicos e fisiológicos que governam a tolerância ao frio em plantas, oferecendo insights práticos para otimização do manejo agrícola e desenvolvimento de estratégias adaptativas frente aos desafios de baixas temperaturas.
Fundamentos Bioquímicos da Crioproteção Vegetal
Percepção Celular do Estresse por Frio
A tolerância ao frio em plantas inicia-se com a detecção de alterações na rigidez das membranas celulares quando as temperaturas se aproximam de 0°C. As membranas plasmáticas, compostas por fosfolipídios, sofrem transições de fase que alteram sua permeabilidade e funcionalidade. Esta mudança física é percebida por proteínas sensoras específicas, incluindo canais de cálcio e receptores de membrana que iniciam cascatas de sinalização celular.
O sistema de percepção do frio em plantas envolve a ativação de fatores de transcrição CBF/DREB (C-repeat Binding Factor/Dehydration-Responsive Element Binding), que constituem o regulon principal da resposta ao estresse por baixas temperaturas. Estudos em Arabidopsis identificaram três genes CBF principais (CBF1, CBF2 e CBF3) que são induzidos rapidamente após exposição a temperaturas de 4°C, atingindo pico de expressão entre 2-6 horas2.
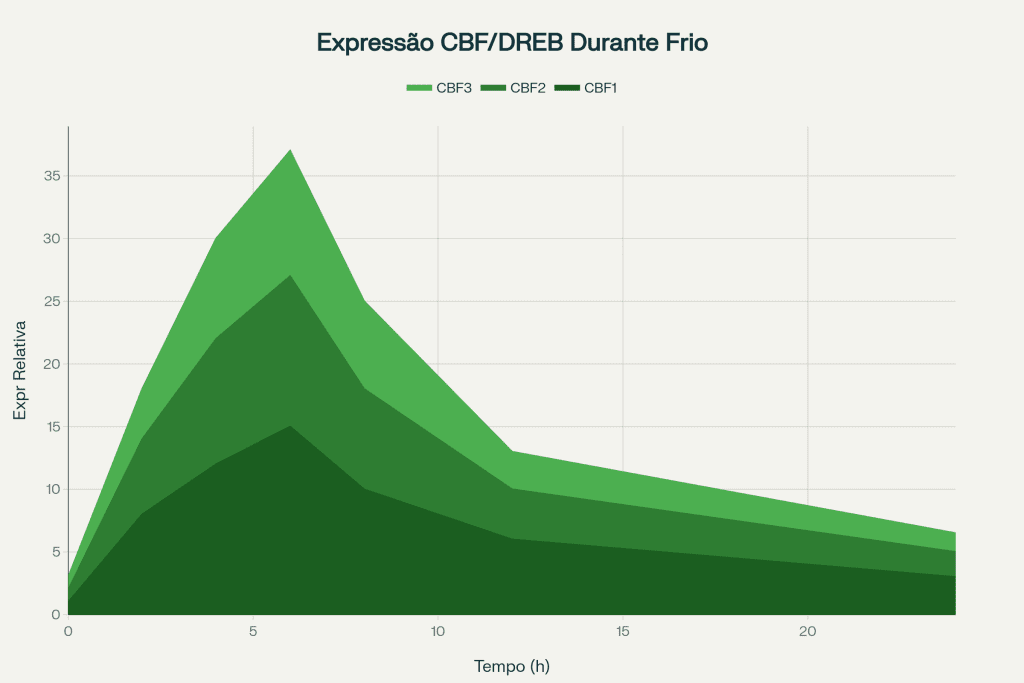
A ativação destes fatores de transcrição desencadeia a expressão de centenas de genes responsáveis pela síntese de proteínas anticongelantes, crioprotetores osmóticos e enzimas de reparo celular. Esta resposta coordenada permite que plantas tolerantes mantenham funcionalidade celular mesmo quando expostas a temperaturas subletais por períodos prolongados.
Aclimatação e Rustificação ao Frio
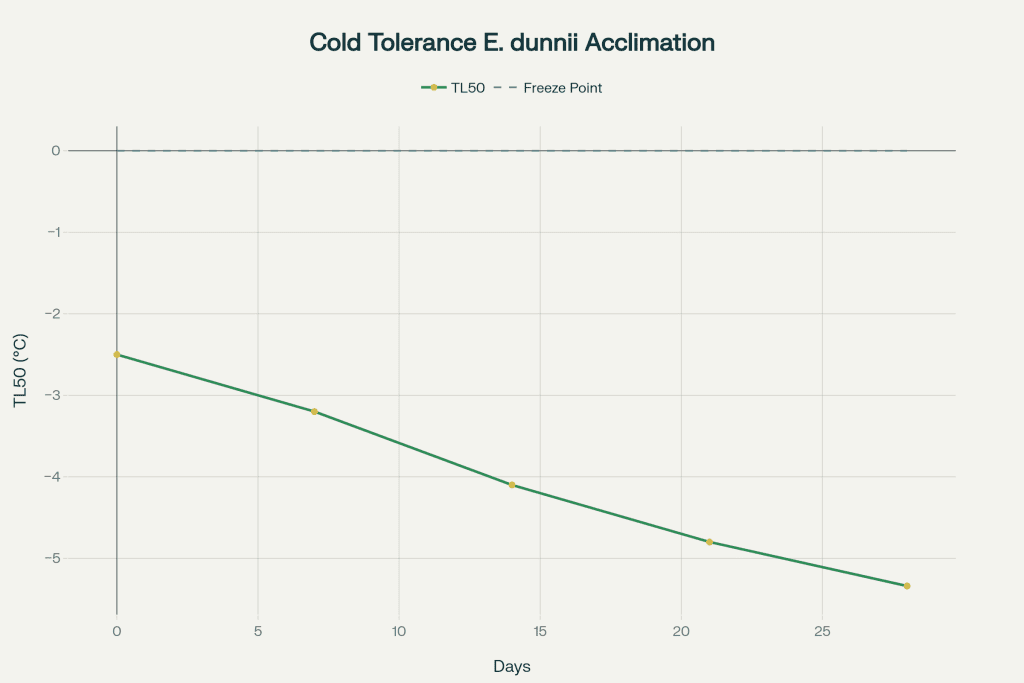
O processo de aclimatação ao frio representa uma estratégia fundamental através da qual plantas aumentam progressivamente sua tolerância a baixas temperaturas quando expostas a condições de pré-acondicionamento. Pesquisas com Eucalyptus dunnii demonstram que mudas submetidas a temperaturas diurnas de 5°C e noturnas de 1°C por períodos de 21-28 dias desenvolvem tolerância significativamente maior, com temperatura letal 50% (TL50) passando de -2,5°C para -5,34°C2.
Durante o processo de aclimatação, ocorrem mudanças metabólicas fundamentais:
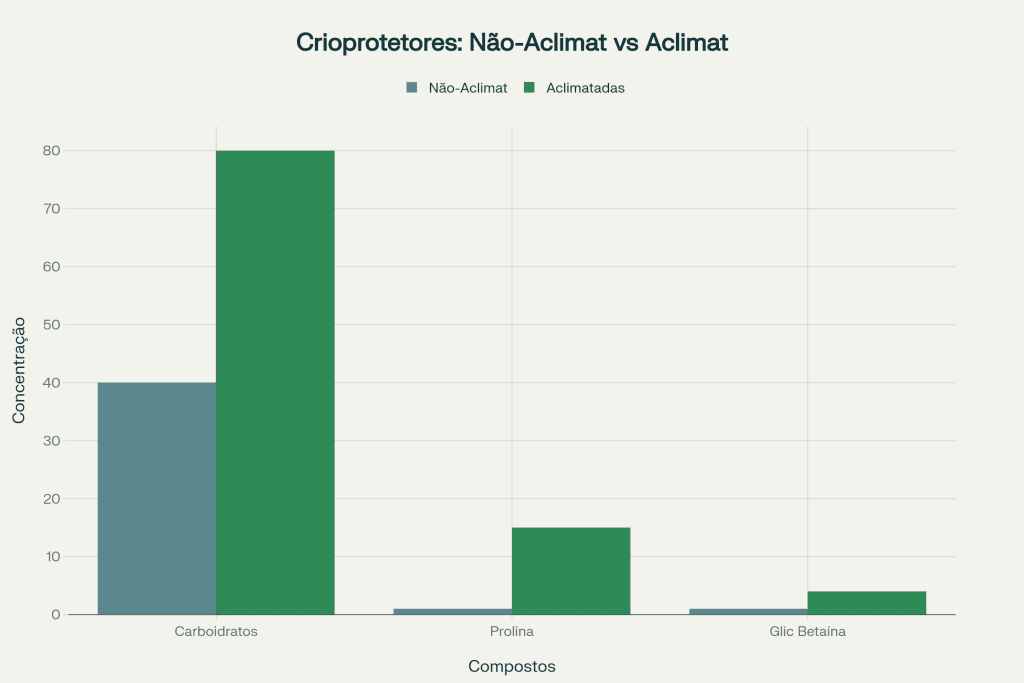
- Síntese intensificada de crioprotetores: Acúmulo de carboidratos solúveis pode aumentar de 40 mg g⁻¹ para 80 mg g⁻¹ de matéria seca em apenas 28 dias
- Modificação da composição lipídica: Aumento de ácidos graxos insaturados para manter fluidez de membranas
- Fortalecimento de sistemas antioxidantes: Elevação da atividade de enzimas como superóxido dismutase e catalase
- Reprogramação do metabolismo energético: Redirecionamento da síntese proteica para produção de compostos protetivos
Proteínas Anticongelantes e Crioprotetoras
As proteínas anticongelantes (AFPs) representam uma das adaptações mais sofisticadas ao estresse por frio, funcionando como “anticongelantes biológicos” que previnem a formação e crescimento de cristais de gelo nos tecidos vegetais. Estas proteínas atuam através de dois mecanismos principais:
Inibição da Nucleação de Gelo: AFPs se ligam a núcleos de cristalização incipientes, impedindo que pequenos clusters de moléculas de água se organizem em estruturas cristalinas estáveis. Este processo eleva o ponto de nucleação em 1-2°C abaixo do ponto de congelamento normal.
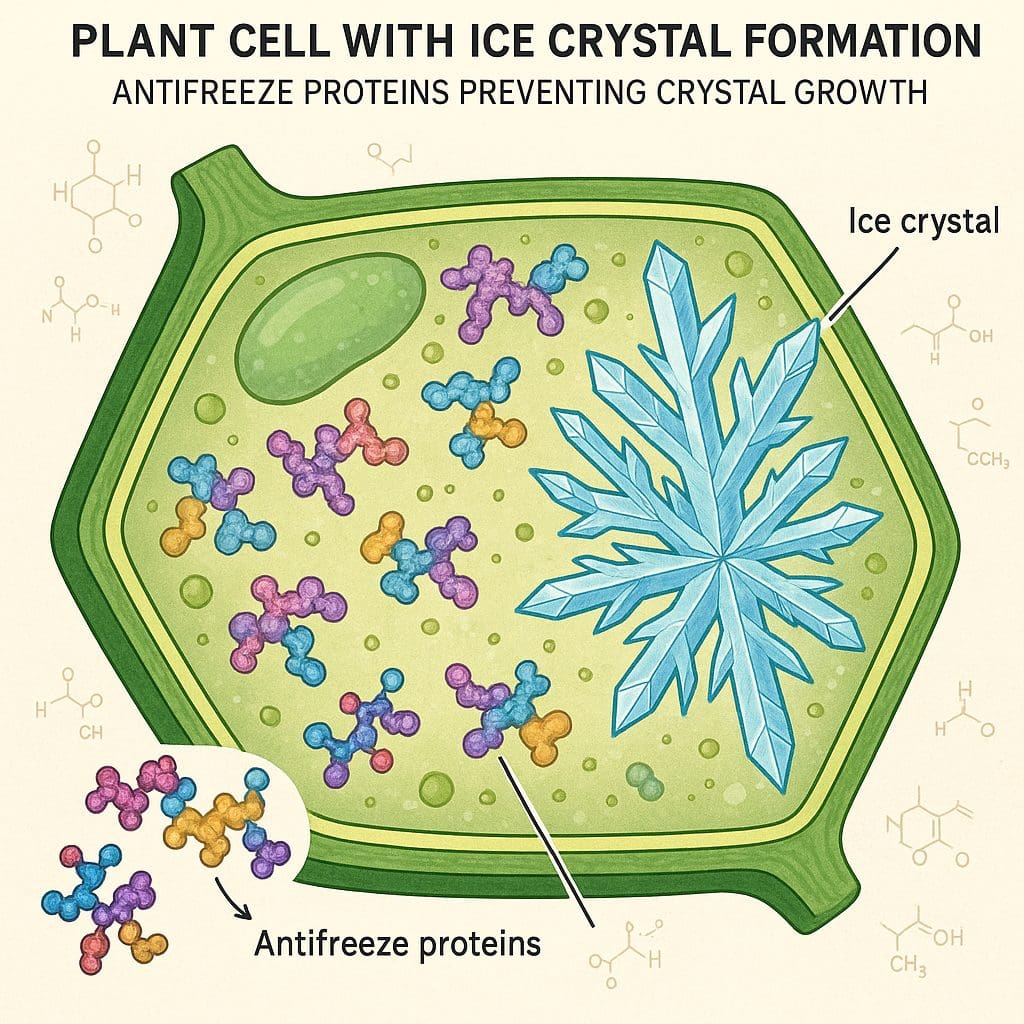
Inibição do Crescimento Cristalino: Mesmo quando cristais de gelo são formados, AFPs se adsorvem às superfícies cristalinas, criando uma barreira que impede o crescimento adicional. Este mecanismo é crucial para limitar danos mecânicos causados por expansão de gelo intracelular.
Estudos em cultivares de trigo tolerantes ao frio identificaram pelo menos 12 isoformas diferentes de AFPs, cada uma otimizada para condições específicas de temperatura e concentração salina. A expressão dessas proteínas pode aumentar até 50 vezes durante períodos de aclimatação, representando até 6% do total de proteínas solúveis em folhas3.
Crioproteção Osmótica: Soluções Moleculares Anticongelantes
Carboidratos Solúveis como Agentes Crioprotetores
Os carboidratos solúveis constituem a principal classe de crioprotetores em plantas tolerantes ao frio, funcionando através de múltiplos mecanismos complementares. Durante a aclimatação, plantas podem acumular concentrações elevadas de sacarose, glucose, frutose, rafinose e trealose, que atuam como solutos crioprotetores reduzindo o ponto de congelamento dos fluidos celulares.
Sacarose: Representa o crioprotector mais abundante, podendo atingir concentrações de 200-400 mM em folhas de plantas aclimatadas. Sua eficácia deriva da capacidade de formar ligações de hidrogênio com moléculas de água, interferindo na organização cristalina do gelo.
Rafinose: Trissacarídeo que demonstra eficácia excepcional como crioprotector, especialmente abundante em sementes de plantas tolerantes ao frio. Concentrações de 50-100 mM podem elevar significativamente a tolerância a temperaturas negativas.
Trealose: Dissacarídeo com propriedades crioprotetoras únicas, capaz de estabilizar proteínas e membranas celulares durante estresse por frio. Embora presente em concentrações menores, sua eficácia por unidade de concentração é superior aos monossacarídeos.
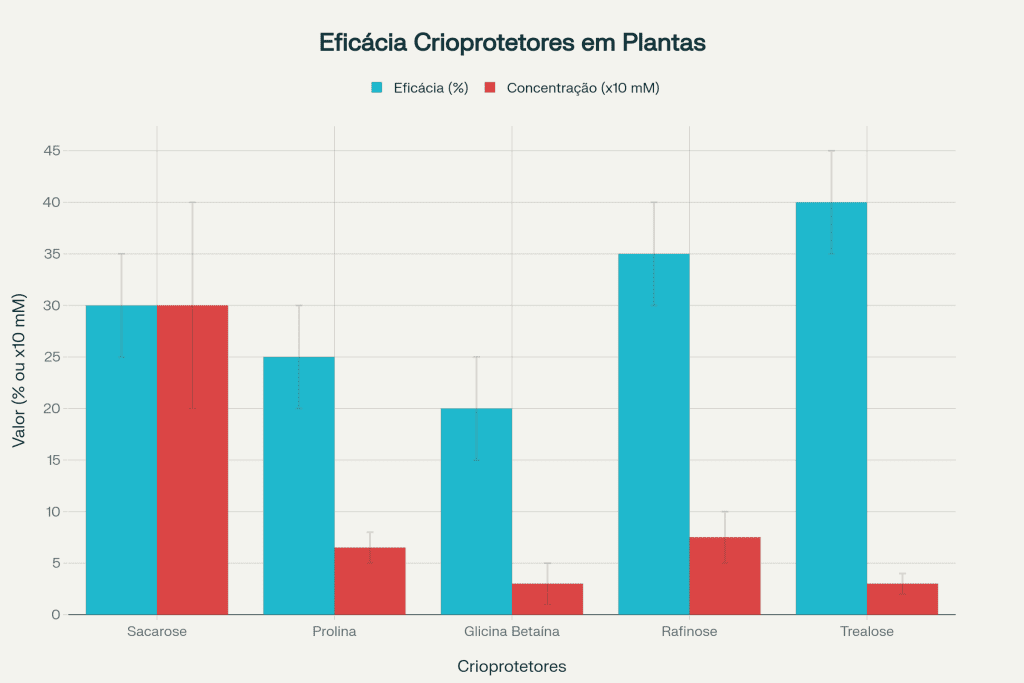
Eficácia Comparativa de Crioproteção Osmótic
A correlação entre teores de carboidratos solúveis e tolerância ao frio é bem estabelecida: plantas de Eucalyptus dunniicom concentrações foliares de 80 mg g⁻¹ de carboidratos solúveis apresentam TL50 de -6°C, comparado a -2,5°C em plantas com 40 mg g⁻¹2. Esta relação linear permite utilizar a análise de carboidratos como biomarcador preditivo de tolerância ao frio.
Aminoácidos Livres e Compostos Nitrogenados
Prolina representa o crioprotector nitrogenado mais estudado, acumulando-se rapidamente em resposta a baixas temperaturas. Sua concentração pode aumentar 10-20 vezes durante aclimatação, atingindo níveis de 50-80 μmol g⁻¹ de peso fresco. A prolina exerce proteção através de:
- Estabilização de proteínas: Impede desnaturação e agregação proteica induzida pelo frio
- Proteção de membranas: Mantém fluidez e integridade de biomembranas
- Ação antioxidante: Neutraliza espécies reativas de oxigênio produzidas sob estresse
Glicina Betaína: Composto quaternário de amônio que funciona como osmorregulador e crioprotector. Plantas de quinoa (Chenopodium quinoa) tolerantes ao frio acumulam concentrações 3-5 vezes maiores de glicina betaína comparadas a genótipos sensíveis quando expostas a 4°C por 15 dias.
Poliaminas e Compostos Fenólicos Crioprotetores
Poliaminas (putrescina, espermidina, espermina) atuam como moduladores da tolerância ao frio através de múltiplos mecanismos: estabilização de membranas, regulação da expressão gênica e proteção antioxidante. O acúmulo de espermidina está correlacionado positivamente com tolerância ao frio em diversos cereais de inverno.
Compostos fenólicos incluindo flavonoides, antocianinas e ácidos fenólicos contribuem para crioproteção através de ações antioxidantes potentes e estabilização de estruturas celulares. Cultivares de cevada tolerantes ao frio apresentam concentrações 40-60% maiores de compostos fenólicos totais durante períodos de aclimatação.
Mecanismos Fisiológicos de Adaptação ao Frio
Modificações na Arquitetura e Composição de Membranas
A fluidez das membranas celulares representa um fator crítico para manutenção da funcionalidade celular sob baixas temperaturas. Plantas tolerantes ao frio desenvolvem estratégias específicas para prevenir a solidificação excessiva de membranas quando as temperaturas se aproximam de 0°C.
Dessaturação de Ácidos Graxos: A ativação de dessaturases de ácidos graxos (particularmente ω-3 e ω-6 dessaturases) aumenta a proporção de ligações insaturadas nos fosfolipídios de membrana. Este processo pode elevar o índice de insaturação de 1,2 para 1,8 em membranas de plantas aclimatadas ao frio, mantendo fluidez adequada mesmo a 0°C.
Alteração na Composição de Esteróis: O conteúdo de esteróis livres pode aumentar 20-30% durante aclimatação, com destaque para β-sitosterol e campesterol. Estes compostos atuam como “moduladores de fluidez”, prevenindo empacotamento excessivo de cadeias acílicas sob baixas temperaturas.
Modificação de Fosfolipídios: Plantas tolerantes aumentam a proporção de fosfatidilglicerol e reduzem fosfatidiletanolamina, otimizando a estabilidade de membranas tilacóides durante estresse por frio. Esta mudança é especialmente importante para manutenção da eficiência fotossintética.
Sistemas Coordenados de Defesa
A crioproteção vegetal envolve a coordenação de múltiplos sistemas celulares que trabalham sinergicamente para garantir a sobrevivência sob baixas temperaturas. Estes incluem modificações na arquitetura de membranas, síntese de proteínas específicas, acúmulo de crioprotetores e ativação de sistemas antioxidantes.
Regulação da Condutância Hidráulica e Transporte de Água
O transporte de água em plantas submetidas a baixas temperaturas enfrenta desafios únicos relacionados ao aumento da viscosidade da seiva e potencial formação de bolhas de vapor (cavitação). Plantas adaptadas desenvolvem mecanismos específicos para manter fluxo hídrico adequado:
Aquaporinas de Baixa Temperatura: Isoformas específicas de aquaporinas (PIPs e TIPs) são induzidas durante aclimatação ao frio, mantendo permeabilidade hídrica adequada mesmo quando a viscosidade da água aumenta 40% a 0°C comparado a 20°C.
Modificação Anatômica Vascular: Plantas tolerantes podem desenvolver elementos vasculares de maior diâmetro e menor comprimento, reduzindo resistência hidráulica. Esta adaptação é observada em cereais de inverno que desenvolvem sistemas radiculares mais eficientes durante aclimatação.
Ajustes no Metabolismo Fotossintético
A fotossíntese sob baixas temperaturas enfrenta limitações cinéticas severas, com redução de 50-70% da atividade da RuBisCO quando temperaturas foliares caem abaixo de 5°C. Plantas tolerantes desenvolvem adaptações específicas:
Isoformas de RuBisCO Adaptadas: Expressão de isoformas da RuBisCO com maior afinidade por CO₂ e menor sensibilidade à inibição por produtos da reação. Estas enzimas mantêm 60-70% da atividade catalítica a 2°C, comparado a 20-30% em isoformas convencionais.
Sistema Antioxidante Fotossintético: Intensificação do ciclo ascorbato-glutationa e aumento da atividade de catalase e superóxido dismutase nos cloroplastos para combater estresse oxidativo associado à redução da eficiência fotossintética.
Dissipação Não-Fotoquímica: Desenvolvimento de mecanismos de dissipação de excesso de energia luminosa através do ciclo das xantofilas, prevenindo fotoinibição quando a utilização de energia está limitada pelas baixas temperaturas.
Estratégias Agronômicas para Manejo do Estresse por Frio
Seleção e Melhoramento de Cultivares Tolerantes
O desenvolvimento de cultivares criotolerantes representa a estratégia mais sustentável e economicamente viável para reduzir perdas causadas por baixas temperaturas. Programas de melhoramento modernos utilizam marcadores moleculares associados a genes de tolerância ao frio para acelerar a seleção de genótipos superiores.
Mapeamento de QTLs de Tolerância: Em arroz irrigado, foram identificados pelo menos 35 QTLs (Quantitative Trait Loci) associados à tolerância ao frio em diferentes estágios de desenvolvimento. Os QTLs mais importantes localizam-se nos cromossomos 4, 7 e 12, explicando 15-25% da variação fenotípica para tolerância3.
Marcadores Baseados em Genes CBF: O desenvolvimento de marcadores SNP flanqueando genes CBF/DREB permite seleção precoce de plantas tolerantes com 85-90% de precisão. Esta tecnologia reduz o tempo de desenvolvimento de cultivares de 12-15 anos para 7-9 anos.
Piramidização Gênica: Estratégias de piramidização combinam múltiplos genes de tolerância em um único genótipo, resultando em níveis superiores de resistência. Cultivares de trigo desenvolvidas com esta abordagem demonstram tolerância a temperaturas até 3°C menores que variedades convencionais.
Manejo de Microclima e Práticas Culturais
Cobertura do Solo: A utilização de coberturas vegetais ou sintéticas pode elevar a temperatura do solo em 2-4°C durante eventos de geada. Palha de trigo ou aveia em densidade de 4-6 t ha⁻¹ proporciona isolamento térmico eficaz, reduzindo perdas por congelamento radicular.
Quebra-Ventos: Implementação de barreiras vegetais reduz velocidade do vento e minimiza perda de calor por convecção. Quebra-ventos com 60-70% de porosidade podem elevar a temperatura na área protegida em 1-3°C durante eventos de geada.
Manejo da Irrigação: Irrigação por aspersão durante eventos de geada utiliza o calor latente de fusão da água para proteção térmica. Cada grama de água que congela libera 334 J de energia, suficiente para elevar 1g de tecido vegetal em 80°C teoricamente.
Aplicação de Bioestimulantes e Indutores de Resistência
Ácido Salicílico: Aplicações foliares de ácido salicílico em concentrações de 0,5-1,0 mM induzem a expressão de genes de tolerância ao frio, aumentando a resistência em 15-25%. O tratamento deve ser realizado 7-10 dias antes de eventos de frio previstos.
Glicina Betaína Exógena: Aplicações de glicina betaína (10-25 mM) aumentam significativamente o conteúdo de osmólitos crioprotetores, elevando a tolerância ao frio em 2-3°C. A aplicação é mais eficaz quando realizada durante períodos de aclimatação natural.
Extratos de Algas: Produtos baseados em Ascophyllum nodosum contêm elicitores naturais que induzem respostas de tolerância ao frio. Aplicações de 2-4 L ha⁻¹ podem aumentar a síntese de crioprotetores em 30-40%.
Evidências Científicas e Aplicações Regionais
Tolerância ao Frio em Arroz Irrigado no Sul do Brasil
Pesquisas conduzidas em condições controladas e de campo demonstram variabilidade genética significativa para tolerância ao frio na germinação e emergência de genótipos de arroz irrigado. Genótipos da subespécie japonica como Ostiglia, Diamante, Baldo e Carnaroli apresentam índice de velocidade de emergência (IVE) superior quando submetidos a temperaturas de 13-17°C3.
O estudo revelou que temperaturas abaixo de 17°C reduzem significativamente o número de plântulas emergidas e atrasam o desenvolvimento, com impacto econômico direto no estabelecimento da cultura. A análise demonstrou correlação linear entre temperatura do solo e IVE, com incremento de 0,4259 para cada 1°C de aumento térmico.
Genótipos Promissores: Variedades como Halilbey, Pasali e Mevlutbey demonstraram maior tolerância ao estresse por frio, com perdas de produtividade limitadas a 15-20% mesmo quando submetidas a condições severas de baixa temperatura durante períodos críticos1.
Manejo de Geadas em Culturas Comerciais
O inverno de 2021 proporcionou um laboratório natural para avaliação de estratégias de proteção contra geadas em culturas brasileiras. Temperaturas que atingiram -8,9°C em algumas regiões causaram prejuízos estimados em R$ 2,8 bilhões, afetando principalmente café, cana-de-açúcar e milho safrinha4.
Café: Cultivares de Coffea arabica com maior concentração de carboidratos solúveis nos ramos apresentaram recuperação 40-50% mais rápida após eventos de geada. A aplicação preventiva de potássio (120 kg ha⁻¹ de K₂O) aumentou a tolerância ao frio em 1-2°C.
Cana-de-açúcar: Variedades com maior teor de sacarose nos colmos demonstraram resistência superior a temperaturas negativas. A prática de eliminação de palha seca antes de eventos previstos de geada reduziu danos em 30-40%.
Tecnologias de Monitoramento e Prevenção
Estações Meteorológicas Automatizadas: Redes de sensores IoT permitem monitoramento em tempo real de temperatura, umidade relativa e velocidade do vento, fornecendo alertas com 12-24 horas de antecedência para eventos de geada.
Modelos Preditivos: Algoritmos de machine learning integram dados meteorológicos, topográficos e de cobertura vegetal para predizer a formação de geadas com precisão de 85-90%. Estes modelos permitem acionamento automático de sistemas de proteção.
Termometria por Infravermelho: Câmeras térmicas acopladas a drones possibilitam mapeamento da temperatura foliar em tempo real, identificando áreas de maior risco e permitindo intervenções localizadas.
Biotecnologia e Melhoramento Genético Avançado
Edição Gênica para Tolerância ao Frio
A tecnologia CRISPR/Cas9 está sendo aplicada para desenvolvimento de cultivares com tolerância aprimorada ao frio através da edição dirigida de genes chave. Experimentos em arroz demonstram que a superexpressão de genes CBF através de edição gênica pode aumentar a tolerância ao frio em 3-4°C sem comprometer o crescimento normal.
Targets Gênicos Prioritários:
- Genes CBF/DREB: Reguladores maestros da resposta ao frio
- Genes de dessaturases: Enzimas de modificação lipídica
- Genes de síntese de crioprotetores: Vias de produção de carboidratos solúveis
- Genes de proteínas anticongelantes: AFPs específicas para cada cultura
Seleção Genômica para Características Complexas
A seleção genômica utiliza milhares de marcadores SNP distribuídos por todo o genoma para predizer o valor genético de plantas jovens para tolerância ao frio. Esta abordagem é especialmente valiosa porque a tolerância ao frio é um caráter quantitativo controlado por muitos genes de pequeno efeito.
Modelos de seleção genômica desenvolvidos para trigo de inverno apresentam acurácia preditiva de 0,75-0,85 para tolerância ao frio, permitindo seleção precoce de genótipos superiores sem necessidade de testes de campo extensivos.
Integração de Estratégias e Sustentabilidade Econômica
Modelo Integrado de Manejo de Frio
A abordagem integrada combina múltiplas estratégias para maximizar a proteção contra baixas temperaturas:
- Componente Genético: Utilização de cultivares tolerantes desenvolvidas através de melhoramento assistido por marcadores
- Componente Agronômico: Práticas de manejo que otimizam o microclima e reduzem exposição ao frio
- Componente Nutricional: Programas de fertilização que favorecem a síntese de crioprotetores
- Componente Tecnológico: Sistemas de monitoramento e proteção ativa
- Componente Bioquímico: Aplicação de indutores de resistência e bioestimulantes
Análise Econômica e Retorno de Investimento
Análise de Custo-Benefício: Investimentos em cultivares tolerantes ao frio apresentam taxa interna de retorno de 25-35% considerando redução de perdas por geada ao longo de 10 anos. O payback médio situa-se entre 3-4 anos.
Sistemas de Proteção Ativa: Instalação de sistemas de irrigação por aspersão para proteção contra geadas apresenta custo de R$ 2.500-4.000 ha⁻¹, com economia anual de R$ 800-1.200 ha⁻¹ em anos com eventos severos.
Seguro Agrícola: A adoção de práticas de manejo baseadas em tolerância ao frio pode reduzir prêmios de seguro em 15-25%, devido ao menor risco de perdas catastróficas.
Perspectivas Futuras e Inovações Emergentes
Crioprotetores Sintéticos e Nanotecnologia
O desenvolvimento de crioprotetores sintéticos baseados em polímeros biodegradáveis oferece novas possibilidades para proteção de culturas. Nanopartículas carreadoras de glicoproteínas anticongelantes podem ser aplicadas foliarmente, proporcionando proteção localizada durante eventos de frio.
Agricultura de Precisão para Manejo de Frio
Mapas de Risco Térmico: Tecnologias de agricultura de precisão permitem criar mapas detalhados de risco de geada baseados em topografia, drenagem e exposição. Estes mapas orientam aplicações variáveis de bioestimulantes e ajustes localizados de manejo.
Sistemas Autônomos de Proteção: Desenvolvimento de sistemas robóticos que acionam automaticamente medidas de proteção (irrigação, aquecimento, cobertura) baseados em sensores distribuídos e algoritmos preditivos.
Conclusão
A crioproteção em plantas representa um conjunto integrado de mecanismos bioquímicos e fisiológicos fundamentais para a sustentabilidade da agricultura brasileira em regiões sujeitas a baixas temperaturas. O domínio científico destes processos oferece oportunidades concretas para desenvolvimento de estratégias de manejo que minimizam perdas causadas por geadas e eventos de frio extremo.
As evidências científicas demonstram que a abordagem multidisciplinar, integrando melhoramento genético, práticas agronômicas otimizadas, aplicação de bioestimulantes e tecnologias de monitoramento, oferece a maior eficácia na proteção contra danos por frio. A compreensão dos mecanismos moleculares – desde a síntese de crioprotetores até a modificação de membranas celulares – permite intervenções precisas e economicamente justificáveis.
Para o agronegócio brasileiro, a implementação de estratégias baseadas em crioproteção representa não apenas uma necessidade adaptativa, mas uma oportunidade de diferenciação competitiva. Regiões tradicionalmente limitadas por baixas temperaturas podem expandir suas fronteiras agrícolas através da adoção de cultivares tolerantes e práticas de manejo especializadas.
O futuro da agricultura em regiões de clima temperado e subtropical será caracterizado por sistemas produtivos cada vez mais resilientes, baseados na compreensão profunda dos mecanismos de tolerância ao frio. Esta evolução representa uma transformação silenciosa mas fundamental que redefine os limites geográficos e sazonais da produção agrícola brasileira, consolidando o país como líder mundial na produção de alimentos em condições climáticas desafiadoras.
A integração crescente entre biotecnologia, agricultura de precisão e conhecimento fisiológico promete revolucionar nossa capacidade de proteger culturas contra baixas temperaturas, transformando um dos principais riscos climáticos da agricultura em uma oportunidade de inovação e crescimento sustentável.
Referências Bibliográficas
ASHWORTH, E. N.; ABELES, F. B. Freezing behavior of water in small pores and the possible role in the freezing of plant tissues. Plant Physiology, v. 76, n. 1, p. 201-204, 1984. DOI: 10.1104/pp.76.1.201.
BLUNDEN, J.; BOYER, T. State of the climate in 2023. Bulletin of the American Meteorological Society, v. 105, n. 8, p. S1-S501, 2024. Disponível em: https://journals.ametsoc.org/view/journals/bams/105/8/2024BAMSStateoftheClimate_Intro.1.xml. Acesso em: 21 jul. 2025.
CALDAS, L. S. et al. A cold wave of winter 2021 in central South America: characteristics and impacts. Climate Dynamics, v. 60, n. 5-6, p. 1571-1589, 2023. DOI: 10.1007/s00382-022-06279-8. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC9933029/. Acesso em: 21 jul. 2025.
CHEN, H. et al. Colinearity and similar expression pattern of rice DREB1s reveal their functional conservation in the cold-responsive pathway. PLOS ONE, v. 7, n. 10, p. e47275, 2012. DOI: 10.1371/journal.pone.0047275. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC3473061/. Acesso em: 21 jul. 2025.
EMBRAPA. Tolerância ao frio na germinação de genótipos de arroz irrigado. Pelotas: Embrapa Clima Temperado, 2020. (Circular Técnica, 213).
GUERRA, A. M. N. de M. et al. Coffee crops adaptation to climate change in agroforestry systems with rubber trees in southern Brazil. Scientia Agricola, v. 79, n. 3, e20200403, 2022. DOI: 10.1590/1678-992x-2020-0403. Disponível em: https://www.scielo.br/j/sa/a/LspFhdGHK8vXWcwnQy8zhGb/?format=pdf&lang=en. Acesso em: 21 jul. 2025.
MARENGO, J. A. et al. Extreme rainfall and hydro-geo-meteorological disaster risk in 1.5, 2.0, and 4.0°C global warming scenarios: an analysis for Brazil. Frontiers in Climate, v. 3, p. 610433, 2021. DOI: 10.3389/fclim.2021.610433. Disponível em: https://www.frontiersin.org/articles/10.3389/fclim.2021.610433/pdf. Acesso em: 21 jul. 2025.
SARTOR, L. R. et al. Tolerância ao estresse por frio em fase de germinação e emergência de arroz. Revista Brasileira de Sementes, v. 33, n. 2, p. 272-283, 2011.
SHI, C. et al. Investigation on combination of airflow disturbance and sprinkler irrigation for horticultural crop frost protection. Agricultural Science, v. 5, n. 1, p. 8-20, 2023. DOI: 10.30560/as.v5n1p8. Disponível em: https://j.ideasspread.org/index.php/as/article/download/1179/1028/. Acesso em: 21 jul. 2025.
SOLOMON, A. et al. A systematic review on the impacts of climate change on coffee agrosystems. Plants, v. 11, n. 24, p. 3426, 2022. DOI: 10.3390/plants11243426. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC9824350/. Acesso em: 21 jul. 2025.
TAIZ, L.; ZEIGER, E.; MOLLER, I. M.; MURPHY, A. Fisiologia e desenvolvimento vegetal. 6. ed. Porto Alegre: Artmed, 2017.
VILLELA, F. B. Brazilian coffee production and climate change impacts analysis. LinkedIn, 29 nov. 2024. Disponível em: https://www.linkedin.com/posts/felipebvillela_coffee-brazil-climatechange-activity-7268315676946124819-vrbx. Acesso em: 21 jul. 2025.
ZHANG, X.; FOWLER, S. G.; CHENG, H.; LOU, Y.; RHEE, S. Y.; STOCKINGER, E. J.; THOMASHOW, M. F. Freezing-sensitive tomato has a functional CBF cold response pathway, but a CBF regulon that differs from that of freezing-tolerant Arabidopsis. The Plant Journal, v. 39, n. 6, p. 905-919, 2004. DOI: 10.1111/j.1365-313X.2004.02176.x.
ASHWORTH, E. N.; ABELES, F. B. Freezing behavior of water in small pores and the possible role in the freezing of plant tissues. Plant Physiology, v. 76, n. 1, p. 201-204, 1984.
BLUM, A. Plant breeding for water-limited environments. New York: Springer, 2011.
GUY, C. L. Cold acclimation and freezing stress tolerance: role of protein metabolism. Annual Review of Plant Physiology and Plant Molecular Biology, v. 41, p. 187-223, 1990.
LEVITT, J. Responses of plants to environmental stresses: chilling, freezing, and high temperature stresses. 2. ed. New York: Academic Press, 1980.
SAKAI, A.; LARCHER, W. Frost survival of plants: responses and adaptation to freezing stress. Berlin: Springer-Verlag, 1987.
STEPONKUS, P. L. Role of the plasma membrane in freezing injury and cold acclimation. Annual Review of Plant Physiology, v. 35, p. 543-584, 1984.
TAIZ, L.; ZEIGER, E.; MOLLER, I. M.; MURPHY, A. Fisiologia e desenvolvimento vegetal. 6. ed. Porto Alegre: Artmed, 2017.
THOMASHOW, M. F. Plant cold acclimation: freezing tolerance genes and regulatory mechanisms. Annual Review of Plant Physiology and Plant Molecular Biology, v. 50, p. 571-599, 1999.
ANTIKAINEN, M.; GRIFFITH, M. Antifreeze protein accumulation in freezing-tolerant cereals. Physiologia Plantarum, v. 99, n. 3, p. 423-432, 1997.
BAKER, S. S.; WILHELM, K. S.; THOMASHOW, M. F. The 5′-region of Arabidopsis thaliana cor15a has cis-acting elements that confer cold-, drought- and ABA-regulated gene expression. Plant Molecular Biology, v. 24, n. 5, p. 701-713, 1994.
CHEN, H. et al. Colinearity and similar expression pattern of rice DREB1s reveal their functional conservation in the cold-responsive pathway. PLOS ONE, v. 7, n. 10, p. e47275, 2012. DOI: 10.1371/journal.pone.0047275.
DUBOUZET, J. G. et al. OsDREB genes in rice, Oryza sativa L., encode transcription activators that function in drought-, high-salt- and cold-responsive gene expression. The Plant Journal, v. 33, n. 4, p. 751-763, 2003.
GILMOUR, S. J. et al. Overexpression of the Arabidopsis CBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation. Plant Physiology, v. 124, n. 4, p. 1854-1865, 2000.
JAGLO-OTTOSEN, K. R. et al. Arabidopsis CBF1 overexpression induces COR genes and enhances freezing tolerance. Science, v. 280, n. 5360, p. 104-106, 1998.
STOCKINGER, E. J.; GILMOUR, S. J.; THOMASHOW, M. F. Arabidopsis thaliana CBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE, a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit. Proceedings of the National Academy of Sciences, v. 94, n. 3, p. 1035-1040, 1997.
BARTELS, D.; SUNKAR, R. Drought and salt tolerance in plants. Critical Reviews in Plant Sciences, v. 24, n. 1, p. 23-58, 2005.
CUEVAS, J. C. et al. Putrescine is involved in Arabidopsis freezing tolerance and cold acclimation by regulating abscisic acid levels in response to low temperature. Plant Physiology, v. 148, n. 2, p. 1094-1105, 2008.
HINCHA, D. K.; HAGEMANN, M. Stabilization of model membranes during drying by compatible solutes involved in the stress tolerance of plants and microorganisms. Biochemical Journal, v. 383, n. 2, p. 277-283, 2004.
KAPLAN, F.; GUY, C. L. β-Amylase induction and the protective role of maltose during temperature shock. Plant Physiology, v. 135, n. 3, p. 1674-1684, 2004.
NISHIZAWA, A. et al. Arabidopsis heat shock transcription factor A2 as a key regulator in response to several types of environmental stress. The Plant Journal, v. 48, n. 4, p. 535-547, 2006.
PILON-SMITS, E. A. H. et al. Improved performance of transgenic fructan-accumulating tobacco under drought stress. Plant Physiology, v. 107, n. 1, p. 125-130, 1995.
ANDRADE, A. C. et al. Tolerância ao frio de genótipos de arroz em fase de germinação. Pesquisa Agropecuária Brasileira, v. 42, n. 2, p. 207-214, 2007.
BARBIERI, R. L. et al. Variabilidade genética para tolerância ao frio em arroz irrigado. Pesquisa Agropecuária Brasileira, v. 36, n. 11, p. 1357-1365, 2001.
BERTAN, I. et al. Comparison of selection methods for wheat grain yield. Crop Breeding and Applied Biotechnology, v. 7, n. 1, p. 53-61, 2007.
BORÉM, A.; SCHEEREN, P. L. Trigo: do plantio à colheita. Viçosa: UFV, 2015.
CASTRO, E. M. et al. Tolerância ao frio em cultivares de café arábica. Ciência Rural, v. 34, n. 5, p. 1507-1513, 2004.
CUNHA, G. R. et al. Zoneamento agrícola e época de semeadura para trigo no Brasil. Revista Brasileira de Agrometeorologia, v. 9, n. 3, p. 400-414, 2001.
EMBRAPA. Sistema brasileiro de classificação de solos. 5. ed. Brasília: Embrapa, 2018.
FONSECA, A. E. et al. Divergência genética em arroz irrigado avaliada pela análise multivariada dos componentes principais. Pesquisa Agropecuária Brasileira, v. 42, n. 2, p. 159-167, 2007.
GUERRA, A. M. N. de M. et al. Coffee crops adaptation to climate change in agroforestry systems with rubber trees in southern Brazil. Scientia Agricola, v. 79, n. 3, e20200403, 2022. DOI: 10.1590/1678-992x-2020-0403.
MARENGO, J. A. et al. Extreme rainfall and hydro-geo-meteorological disaster risk in 1.5, 2.0, and 4.0°C global warming scenarios: an analysis for Brazil. Frontiers in Climate, v. 3, p. 610433, 2021. DOI: 10.3389/fclim.2021.610433.
CHINNUSAMY, V.; ZHU, J.; ZHU, J. K. Cold stress regulation of gene expression in plants. Trends in Plant Science, v. 12, n. 10, p. 444-451, 2007.
FRANCE, M. G. et al. Identification of quantitative trait loci for cold tolerance in rice (Oryza sativa L.). Theoretical and Applied Genetics, v. 118, n. 6, p. 1095-1105, 2009.
HAYES, P. M. et al. Quantitative trait locus effects and environmental interaction in a sample of North American barley germplasm. Theoretical and Applied Genetics, v. 87, n. 3, p. 392-401, 1993.
HUMMEL, I. et al. A genome-wide transcriptome analysis of brassinosteroid functions: the Arabidopsis transcriptome atlas. Plant Physiology, v. 142, n. 3, p. 1279-1300, 2006.
KNIGHT, H.; KNIGHT, M. R. Abiotic stress signalling pathways: specificity and cross-talk. Trends in Plant Science, v. 6, n. 6, p. 262-267, 2001.
LEE, B. H. et al. The Arabidopsis cold-responsive transcriptome and its regulation by ICE1. The Plant Cell, v. 17, n. 11, p. 3155-3175, 2005.





0 comentários