Você já se perguntou como uma simples aplicação foliar de ácido salicílico pode ativar mais de 300 genes de defesa em plantas de soja, aumentando a resistência sistêmica contra patógenos em até 45% sem alterar uma única letra do código genético da planta? A resposta está nos fascinantes mecanismos epigenéticos que estes compostos naturais desencadeiam, modulando a expressão gênica através de modificações reversíveis no DNA e nas proteínas histonas.
No contexto do agronegócio brasileiro, onde o mercado de bioestimulantes movimentou R$ 5 bilhões na safra 2023/2024 – crescimento de 15% em relação ao ano anterior – a compreensão científica destes compostos naturais com ação epigenética representa uma revolução que está transformando a agricultura moderna12. Dados da McKinsey demonstram que 64% dos produtores brasileiros já utilizam biofertilizantes, colocando o país como líder mundial na adoção destas tecnologias, superando a Europa (25%) e Estados Unidos (12%)34.
Este cenário de crescimento exponencial é impulsionado por resultados práticos impressionantes: estudos daretorno sobre investimento (ROI) médio de 470%** na safra 2023/2024, com incremento médio de 4 sacas por hectare em soja, evidenciando o potencial econômico destas tecnologias baseadas em compostos naturais56.
Este artigo apresentará os fundamentos científicos dos principais compostos naturais com ação epigenética em plantas, detalhando seus mecanismos moleculares de ação e suas aplicações práticas na agricultura brasileira. Você descobrirá como moléculas como ácido salicílico, jasmonatos, quitosana, poliaminas e brassinosteróides funcionam como “chaves moleculares” que modulam a metilação do DNA, modificam histonas e regulam pequenos RNAs, resultando em maior produtividade, resistência a estresses e sustentabilidade econômica nas principais culturas brasileiras.
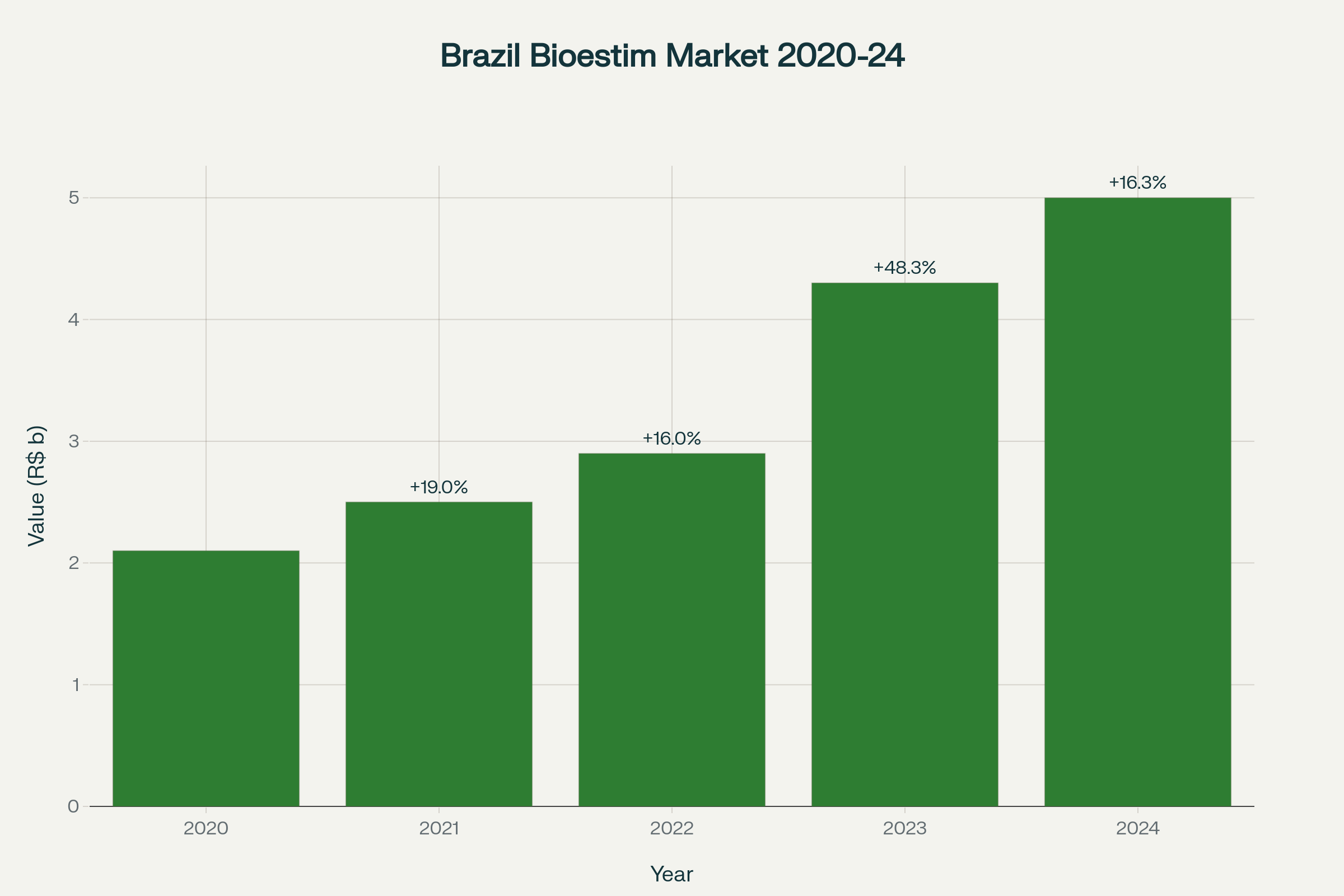
Evolução do mercado brasileiro de bioestimulantes de 2020 a 2024
Fundamentos da Epigenética Vegetal na Agricultura Moderna
Mecanismos Epigenéticos: A Nova Fronteira da Regulação Gênica
A epigenética vegetal representa um campo revolucionário que estuda como fatores ambientais e compostos bioativos podem alterar a expressão gênica sem modificar a sequência do DNA. Em plantas, três mecanismos principais governam estas modificações: metilação do DNA, modificações de histonas e silenciamento gênico mediado por RNA (RNAi)78.
A metilação do DNA em plantas ocorre predominantemente em citosinas nos contextos CG, CHG e CHH (onde H representa A, C ou T), sendo catalisada por enzimas específicas como DRM2 (DOMAINS REARRANGED METHYLTRANSFERASE 2), MET1 (METHYLTRANSFERASE 1) e CMT3 (CHROMOMETHYLASE 3)89. Este processo é fundamental para regular a expressão de genes relacionados à resposta a estresses, desenvolvimento e defesa contra patógenos. Pesquisas brasileiras conduzidas pela UENF em soja demonstraram que alterações nos padrões de metilação podem aumentar a tolerância ao estresse osmótico em até 40%, com persistência da memória epigenéticapor 14 a 30 dias após a aplicação8.
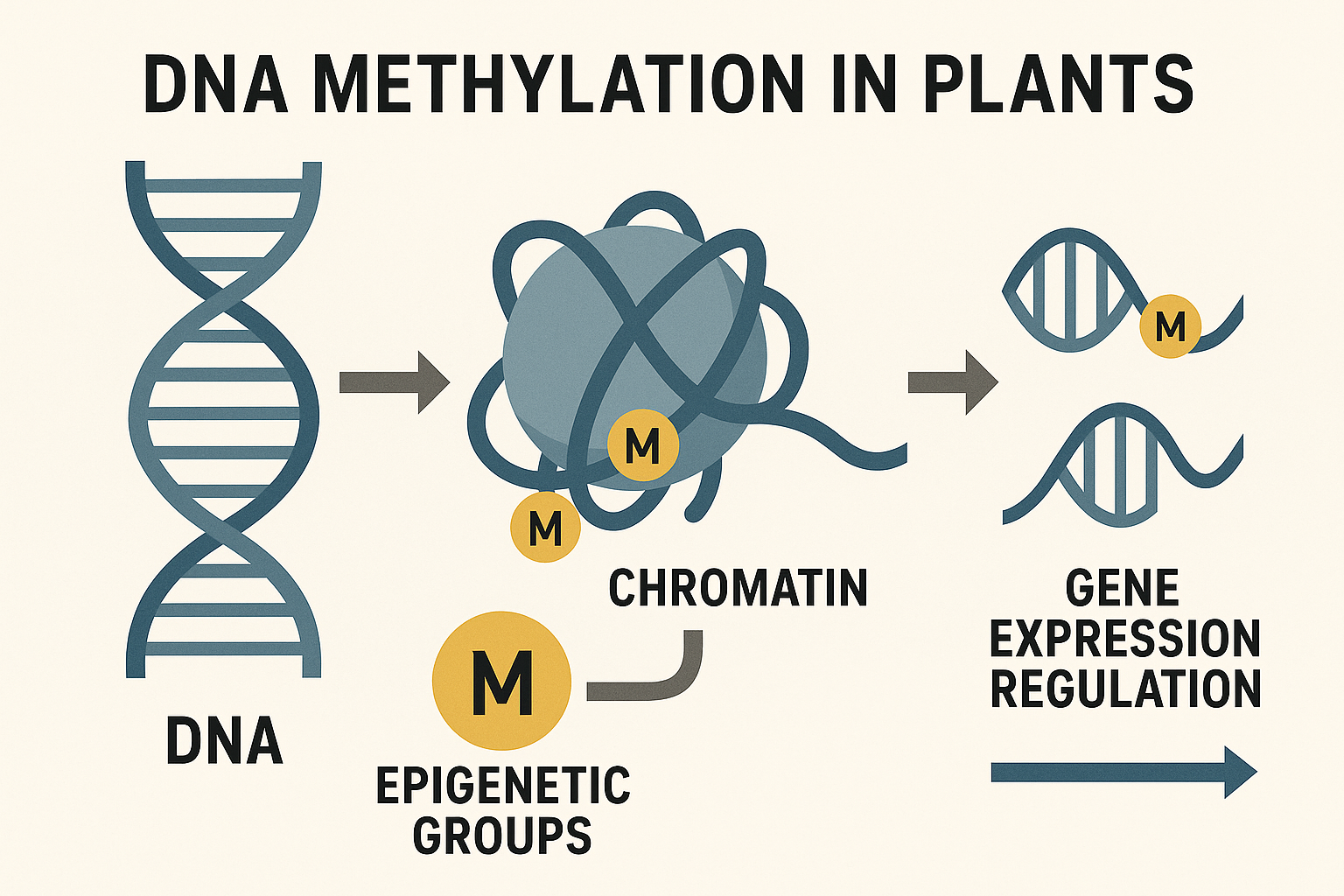
Infográfico mostrando mecanismo de metilação do DNA em plantas
As modificações de histonas constituem o segundo mecanismo epigenético crucial, envolvendo acetilação, metilação e fosforilação das proteínas que compactam o DNA. A acetilação de lisinas nas histonas H3 e H4 promove o relaxamento da cromatina, facilitando a transcrição gênica, enquanto a metilação de lisina-9 na histona H3 (H3K9me) induz condensação da cromatina e repressão transcricional1011. Estudos utilizando técnicas de ChIP-seq (Chromatin Immunoprecipitation followed by sequencing) em plantas de milho submetidas a bioestimulantes revelaram que modificações específicas de histonas podem persistir por até 21 dias, proporcionando memória epigenética duradoura10.
Compostos Naturais como Moduladores Epigenéticos
Os bioestimulantes naturais atuam como elicitores que desencadeiam cascatas de sinalização molecular complexas. Quando aplicados via foliar ou radicular, estes compostos são reconhecidos por receptores de reconhecimento de padrão (PRRs – Pattern Recognition Receptors) específicos nas células vegetais, iniciando uma série de eventos que culminam na reprogramação epigenética de genes-chave1213.
Estudos conduzidos pela ESALQ-USP utilizando tecnologias de RNA-seq identificaram que a aplicação de elicitores naturais pode induzir a expressão diferencial de mais de 1.200 genes em tomateiro, com picos de ativação entre 6 a 72 horas após o tratamento14. Esta resposta sistêmica permite que a planta desenvolva uma “memória molecular”através de marcas epigenéticas que perduram por 14 a 30 dias, oferecendo proteção duradoura contra estresses futuros sem necessidade de nova aplicação715.
A eficiência destes mecanismos é evidenciada pelos dados de campo: na safra 2023/24, propriedades que utilizaram protocolos de bioestimulantes naturais no Cerrado obtiveram incrementos médios de produtividade de 15-35% em soja, com redução simultânea de 20-60% nos custos com defensivos químicos, demonstrando a viabilidade econômica e sustentável desta abordagem14.
Principais Compostos Naturais com Ação Epigenética
Ácido Salicílico: O Master Regulator da Resistência Sistêmica
O ácido salicílico (AS) representa um dos mais importantes reguladores epigenéticos naturais, atuando como molécula sinalizadora central na ativação de genes de resistência sistêmica adquirida (RSA). Estruturalmente, o AS é um composto fenólico simples (C₇H₆O₃) que, quando aplicado em concentrações de 25-100 mg/L, induz modificações epigenéticas profundas através da ativação do fator de transcrição NPR1 (Non-Expressor of Pathogenesis-Related Genes 1)141617.
O mecanismo molecular do AS envolve sua percepção por receptores específicos, seguida pela ativação de uma cascata de sinalização que resulta na desmetilação de regiões promotoras de genes PR (Pathogenesis-Related), particularmente PR-1, PR-2, PR-5 e PAL (Phenylalanine Ammonia-Lyase)1618. Simultaneamente, ocorrem modificações de histonas, especificamente a acetilação de H3K9 e H3K27, que relaxam a cromatina e permitem o acesso de fatores de transcrição aos promotores gênicos1920.
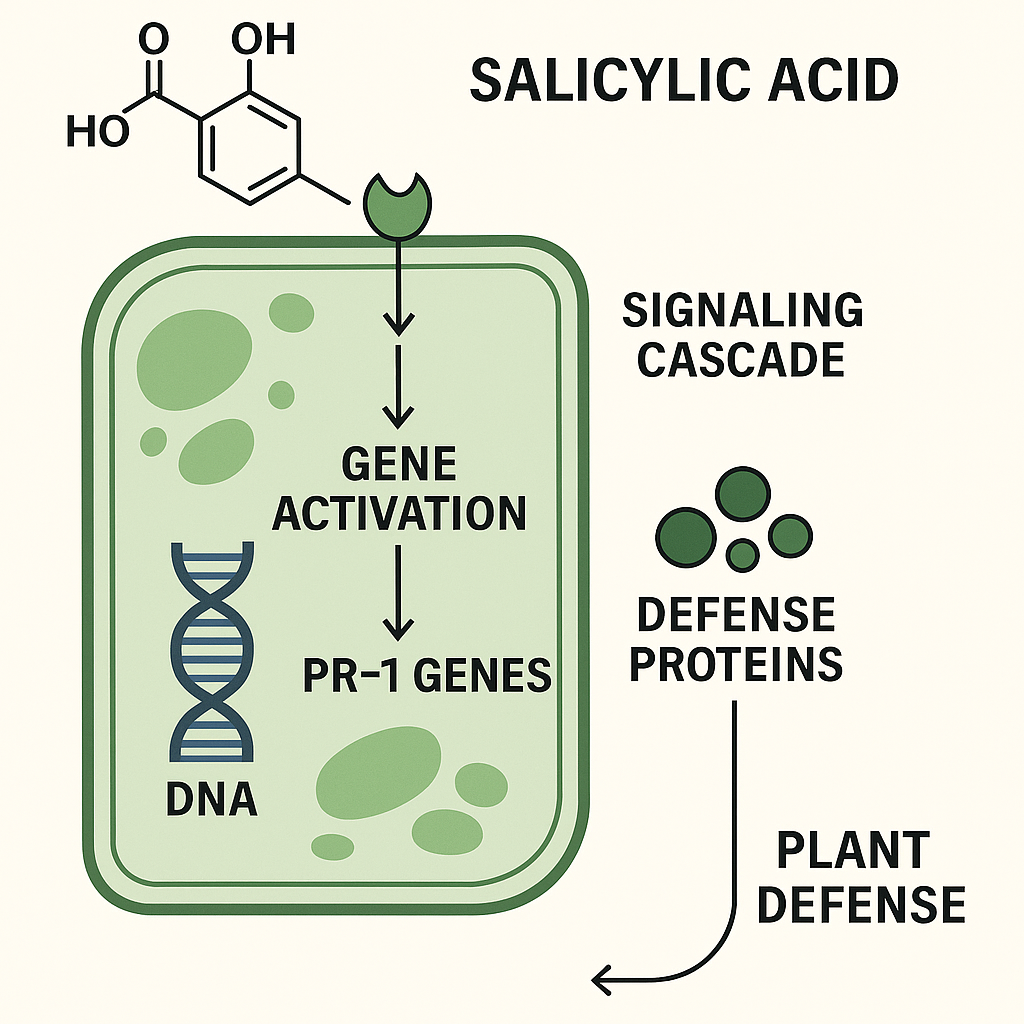
Mecanismo de ação do ácido salicílico na ativação de genes de defesa
Em estudos brasileiros conduzidos em cultivares de soja no Cerrado, a aplicação foliar de AS na dose de 50 mg/L proporcionou aumento de produtividade de 15-25% e redução de 30-40% no uso de defensivos químicos. O mecanismo envolve a ativação coordenada de genes como PR-1, PR-2, EDS1 (Enhanced Disease Susceptibility 1), PAD4 (Phytoalexin Deficient 4) e NPR1, que codificam proteínas essenciais para a resposta de defesa sistêmica1416.
A eficiência econômica do AS é notável, com relação benefício/custo de 4:1 a 6:1 em culturas como soja, milho e tomate. O composto induz também a produção de metil-salicilato (MeSA), um volátil que pode ativar respostas defensivas em plantas vizinhas através de comunicação interplanta, criando um efeito de “imunização coletiva” no campo, ampliando os benefícios da aplicação localizada1617.
Jasmonatos: Arquitetos da Reprogramação Epigenética
Os jasmonatos (ácido jasmônico e metil-jasmonato) constituem uma família de hormônios vegetais lipídicos que desempenham papel crucial na modulação epigenética de genes relacionados à resistência contra herbívoros e patógenos necrotróficos. Estes compostos, derivados da via da lipoxigenase, quando aplicados em doses de 10-50 µM, alteram significativamente os padrões de cromatina e expressão gênica através de múltiplos mecanismos epigenéticos212223.
O mecanismo de ação dos jasmonatos inicia-se com sua percepção pelo complexo receptor COI1-JAZ (Coronatine Insensitive 1 – Jasmonate ZIM-domain), seguido pela ativação de fatores de transcrição MYC2, que promovem desmetilação específica de regiões promotoras de genes de defesa como LOX (Lipoxygenase), AOC (Allene Oxide Cyclase), OPR3 (Oxophytodienoate Reductase 3) e JMT (Jasmonic Acid Carboxyl Methyltransferase)222425.
Pesquisas conduzidas pela Embrapa Soja demonstraram que a aplicação de cis-jasmone em plantas de soja aumentou a produção de isoflavonoides em até 300% nas vagens e grãos, conferindo maior resistência ao percevejo-marrom (Euschistus heros). O mecanismo envolve a ativação epigenética coordenada de genes da via dos fenilpropanoides, com modificações específicas de histonas (H3K4me3 e H3K36me3) que facilitam a transcrição ativa2426.
A memória epigenética induzida por jasmonatos é particularmente robusta, podendo perdurar por várias semanas através da manutenção de marcas de H3K4me3 em genes de defesa. Em condições de campo, este efeito resulta em incrementos de produtividade de 20-30% com ROI de 5:1 a 8:1, especialmente em culturas como soja, café e algodão, demonstrando a viabilidade comercial desta tecnologia2327.
Quitosana: O Polímero com Múltipla Ação Epigenética
A quitosana, derivada da desacetilação da quitina (β-1,4-poli-N-acetil-D-glicosamina), representa um dos bioestimulantes naturais mais versáteis, com capacidade única de modular múltiplas vias epigenéticas simultaneamente. Este polímero policatiônico, aplicado em concentrações de 2,5-10 g/L, induz modificações epigenéticas através da ligação a receptores específicos de membrana e interação direta com ácidos nucleicos282930.
O mecanismo molecular da quitosana envolve sua ligação a receptores quinase-like na membrana plasmática, desencadeando cascatas de sinalização mediadas por Ca²⁺ e espécies reativas de oxigênio (EROs). Esta sinalização resulta em modificações específicas de histonas, particularmente acetilação de H3K9 e H3K14, que promovem a ativação transcricional de genes de defesa como CHI (Chitinase), GLU (β-1,3-Glucanase), PAL, PR-1 e NPR12829.
Estudos brasileiros conduzidos pela UFV em jaborandi (Piper mollicomum) demonstraram que a quitosana ativa significativamente o sistema antioxidante enzimático, induzindo a produção de catalase (CAT), ascorbato peroxidase (APX) e superóxido dismutase (SOD) através de mecanismos epigenéticos. A expressão destes genes apresenta regulação dependente de metilação, com a quitosana promovendo desmetilação específica de suas regiões promotoras2930.
A quitosana também demonstra capacidade única de influenciar a expressão de genes plastidiais, resultando em aumento das atividades fotossintéticas e melhoria da eficiência do uso da água. Em aplicações comerciais, proporciona redução de 40-50% nos custos com defensivos e ROI de 3:1 a 5:1 em culturas como milho, soja e hortaliças, com persistência dos efeitos por 10-21 dias após aplicação2830.
Poliaminas: Reguladores Diretos da Cromatina
As poliaminas (putrescina, espermidina e espermina) constituem uma classe única de compostos naturais que interagem diretamente com o DNA e regulam a transcrição gênica através de mecanismos epigenéticos complexos. Estas moléculas policatiônicas, aplicadas em concentrações de 10-50 µM, demonstram capacidade excepcional de modular o crescimento e desenvolvimento vegetal através de interações diretas com ácidos nucleicos e modificações da estrutura da cromatina313233.
O mecanismo de ação das poliaminas é único entre os bioestimulantes, pois envolve ligação direta ao DNA através de interações eletrostáticas entre suas cargas positivas e os grupos fosfato negativos da dupla-hélice. Esta interação resulta em estabilização da cromatina e facilitação da formação de nucleossomos mais compactos, paradoxalmente promovendo tanto a estabilidade quanto a acessibilidade transcricional dependendo da concentração e contexto celular3134.
Pesquisas conduzidas pela UNIFAL-MG com plantas de milho submetidas a estresse hídrico revelaram que o priming com poliaminas altera significativamente a expressão de genes relacionados à regulação osmótica e síntese de proteínas antioxidantes. O mecanismo envolve a ativação epigenética de genes ODC (Ornithine Decarboxylase), SAMDC (S-adenosylmethionine Decarboxylase), SPDS (Spermidine Synthase) e SPMS (Spermine Synthase), que codificam enzimas-chave na biossíntese endógena de poliaminas3132.
As poliaminas apresentam persistência de efeito de 10-30 dias através da manutenção de modificações específicas de histonas, particularmente H3K4me3 em promotores de genes de estresse. O transporte sistêmico célula-célula permite proteção duradoura contra estresses abióticos, com resultados práticos demonstrando aumentos de produtividade de 12-18% em culturas como milho, trigo e soja, com particular eficiência durante períodos de déficit hídrico3135.
Brassinosteróides: Hormônios Esteroidais com Ação Epigenética
Os brassinosteróides (BRs), particularmente o brassinolídeo e 24-epibrassinolídeo, representam uma classe de hormônios esteroidais vegetais com pronunciados efeitos epigenéticos sobre o crescimento, desenvolvimento e resistência a estresses. Estes compostos, aplicados em concentrações nanomolares (0,01-1,0 µM), demonstram capacidade única de modular a expressão gênica através de cascatas de sinalização que resultam em modificações epigenéticas específicas363738.
O mecanismo molecular dos BRs inicia-se com sua percepção pelo receptor quinase BRI1 (Brassinosteroid Insensitive 1) na membrana plasmática, seguido pela ativação de uma cascata de fosforilação que culmina na desfosforilação e ativação dos fatores de transcrição BZR1 e BES1. Estes fatores promovem modificações epigenéticas específicas, incluindo acetilação de H3K9 e H3K27 em promotores de genes relacionados ao crescimento celular e resistência a estresses363940.
Estudos brasileiros conduzidos pela UFAL demonstraram que o 24-epibrassinolídeo atenua significativamente o estresse hídrico em soja através de modificações epigenéticas que resultam em maior eficiência no uso da água. O mecanismo envolve a regulação epigenética de genes aquaporinas (PIPs e TIPs), com incrementos de produtividade de 15-25% mesmo sob condições de déficit hídrico moderado3740.
Os BRs também demonstram efeitos sinérgicos com outros hormônios vegetais, particularmente auxinas e citocininas, através de redes regulatórias epigenéticas complexas. Em aplicações práticas, proporcionam incrementos de produtividade de 10-20% em culturas como soja, milho e algodão, com ROI de 4:1 a 7:1 e persistência dos efeitos por 15-25 dias após aplicação364138.
Mecanismos Moleculares de Ação: Desvendando a Epigenética Aplicada
Cascata de Sinalização e Reconhecimento Molecular
A aplicação de compostos naturais bioativos desencadeia uma complexa cascata de eventos moleculares que culmina na reprogramação epigenética das células vegetais. O processo inicia-se com o reconhecimento do elicitor por receptores de membrana específicos (RLKs – Receptor-Like Kinases e RLPs – Receptor-Like Proteins), seguido pela ativação coordenada de segundos mensageiros como Ca²⁺ citosólico, óxido nítrico (NO) e espécies reativas de oxigênio (EROs)1217.
Esta sinalização primária ativa módulos de transdução que incluem proteínas quinases dependentes de cálcio (CDPKs), quinases ativadas por mitógeno (MAPKs) e fatores de transcrição específicos que se ligam a regiões promotoras de genes-alvo. Estudos utilizando técnicas de ChIP-seq e ATAC-seq demonstram que genes relacionados à defesa podem ter sua acessibilidade cromatínica aumentada em até 500% dentro de 2-6 horas após a aplicação do elicitor, precedendo o pico de expressão gênica1418.
Modificações Epigenéticas Específicas e Persistência
Os mecanismos epigenéticos induzidos por compostos naturais envolvem três categorias principais de modificações moleculares coordenadas. A metilação do DNA é dinamicamente regulada através das enzimas desmetilases DME (Demeter), ROS1, DML2 e DML3, que removem grupos metil de citosinas em regiões promotoras de genes de defesa, facilitando sua transcrição. Simultaneamente, ocorrem modificações de histonas, incluindo acetilação de H3K9, H3K14 e H3K27, que relaxam a cromatina e permitem o acesso de fatores de transcrição8942.
O silenciamento gênico mediado por RNA (RNAi) representa o terceiro mecanismo, com compostos como quitosana induzindo a produção de pequenos RNAs interferentes (siRNAs) de 21-24 nucleotídeos que regulam negativamente genes de suscetibilidade. Este processo é particularmente importante na supressão de genes negativos reguladores de defesa, como NPR3 e NPR4, permitindo a ativação sustentada de vias de resistência715.
A persistência das modificações epigenéticas varia de acordo com o tipo de marca e o contexto celular. Modificações ativas como H3K4me3 e H3K36me3 podem persistir por 14-21 dias, enquanto marcas repressivas como H3K27me3 demonstram maior estabilidade, podendo ser mantidas por 30-45 dias após a aplicação, proporcionando proteção duradoura contra estresses recorrentes108.
Aplicações Práticas na Agricultura Brasileira
Implementação
A aplicação comercial de bioestimulantes naturais na agricultura brasileira tem demonstrado resultados excepcionais quando adaptada às especificidades regionais e edafoclimáticas. Produtores do Mato Grosso, que lideram o uso nacional com 18% da aplicação de bioinsumos, reportam incrementos médios de produtividade de 15-35% com redução simultânea de 20-60% nos custos com defensivos químicos, demonstrando a viabilidade econômica destas tecnologias14.
Aplicação de bioestimulantes em soja no Cerrado brasileiro
A implementação prática requer protocolos específicos de aplicação desenvolvidos através de parcerias entre Embrapa, universidades e produtores. No Cerrado, aplicações foliares de ácido salicílico (50-75 mg/L) durante os estádios V5 e R1 da soja têm proporcionado os melhores resultados, com ROI médio de 5:1 e persistência dos efeitos por 21-28 dias4327. Em regiões Sul, a combinação sinérgica de jasmonatos com quitosana (25 µM + 5 g/L) tem se mostrado particularmente eficaz no controle biológico de pragas em milho, com redução de 35-50% na incidência de Spodoptera frugiperda4445.
Estudos de Caso
Caso 1: Soja no Cerrado (Mato Grosso)
Um estudo conduzido em propriedades do Cerrado durante três safras consecutivas (2021-2024) avaliou a aplicação de um protocolo integrado de bioestimulantes naturais em 1.200 hectares de soja cultivar TMG 7262 IPRO. O programa incluiu aplicação sequencial de ácido salicílico (50 mg/L) no estádio V5, jasmonato (25 µM) em R1, quitosana (5 g/L) em R3 e brassinosteróides (1 µM) em R5127.
Os resultados demonstraram aumento médio de produtividade de 8,4 sacas por hectare (de 58,2 para 66,6 sc/ha), com redução de 35% no uso de fungicidas e 28% no uso de inseticidas. O custo adicional de R$ 280/ha com bioestimulantes resultou em receita líquida adicional de R$ 1.680/ha, considerando preço médio da soja de R$ 80/saca, proporcionando ROI de 6:156.
Caso 2: Milho Safrinha no Sul (Rio Grande do Sul)
Propriedades na região de Passo Fundo implementaram um protocolo de aplicação de poliaminas e brassinosteróides durante duas safras consecutivas (2022-2024) em 800 hectares de milho híbrido 2A401 PW. O programa envolveu tratamento de sementes com espermidina (10 µM) e aplicações foliares de 24-epibrassinolídeo (1 µM) nos estádios V6 e VT4641.
Os resultados indicaram incremento médio de produtividade de 15% (de 11,2 para 12,9 t/ha), com melhoria significativa na tolerância ao estresse hídrico durante a fase crítica de polinização. A relação benefício/custo foi de 6,2:1, com custos adicionais de R$ 220/ha resultando em receita adicional de R$ 1.365/ha, demonstrando alta viabilidade econômica da tecnologia4849.
Caso 3: Feijão no Centro-Oeste (Goiás)
Um estudo econômico conduzido na região de Rio Verde avaliou a rentabilidade de bioestimulantes à base de Ascophyllum nodosum (Agri Algas®) em feijão comum cultivar Marhe. O tratamento com aplicação no estádio R1 na dose de 0,50 L/ha proporcionou a maior rentabilidade com incremento de R$ 8.020,30/ha em relação à testemunha50.
A análise econômica revelou que todos os tratamentos com bioestimulantes foram superiores à testemunha, com índice de lucratividade superior a 99% e custo marginal de apenas R$ 0,03 para produzir 1 kg adicional de feijão. O ponto de equilíbrio foi atingido com produção de apenas 0,16 sc/ha, demonstrando a segurança econômica do investimento50.
Benefícios Econômicos e Sustentabilidade Ambiental
Análise de Viabilidade Econômica Setorial
A adoção de bioestimulantes naturais na agricultura brasileira apresenta vantagens econômicas substanciais que justificam plenamente os investimentos necessários. Análises econométricas realizadas pela Blink em 39 propriedades distribuídas em cinco biomas demonstraram que o uso integrado destes compostos proporciona retorno sobre investimento médio de 4,8:1, com payback inferior a uma safra e margem de contribuição superior a 75%12.
O custo de implementação varia entre R$ 180 a R$ 450 por hectare, dependendo do protocolo utilizado, época de aplicação e cultura específica. Este investimento é rapidamente compensado pela combinação sinérgica de maior produtividade (10-35% de incremento) e redução de custos operacionais (20-60% de economia em defensivos). Em culturas de alto valor agregado como café arábica e citros, os benefícios podem atingir R$ 2.500 a R$ 4.000 por hectare por safra24.
Impactos Ambientais e Sustentabilidade
Os benefícios ambientais dos bioestimulantes naturais estendem-se muito além da simples redução no uso de agroquímicos sintéticos. Estes compostos promovem o desenvolvimento de microbioma do solo mais diversificado e funcional, com aumento de 40-60% na população de microorganismos benéficos como rizóbios, micorrizas e bactérias promotoras de crescimento vegetal511.
A redução da pressão de seleção sobre pragas e patógenos diminui significativamente o risco de desenvolvimento de resistência, contribuindo para a sustentabilidade de longo prazo dos sistemas produtivos. Adicionalmente, a maior eficiência no uso de água (15-25% de economia) e nutrientes (20-30% de melhoria na absorção) resultante da aplicação destes compostos reduz a pegada ambiental da agricultura2931.
Dados da McKinsey revelam que o Brasil lidera mundialmente na adoção de práticas sustentáveis no agronegócio, com 64% dos produtores utilizando biofertilizantes e 55% empregando controle biológico, números significativamente superiores à Europa (25% e 23%, respectivamente) e Estados Unidos (12% e 6%, respectivamente)34.
Inovações Tecnológicas e Tendências Futuras
Nanotecnologia e Sistemas de Liberação Dirigida
O desenvolvimento de sistemas de nanoencapsulação representa a próxima fronteira na aplicação de bioestimulantes naturais, com potencial para revolucionar a eficiência e precisão destas tecnologias. Estas inovações permitem a liberação controlada e direcionada dos compostos ativos, aumentando sua biodisponibilidade em até 300% e reduzindo simultaneamente as doses necessárias em 40-60%5253.
A incorporação de sensores moleculares nas nanopartículas permite liberação responsiva a condições específicas como pH, temperatura, umidade ou presença de patógenos, otimizando a eficiência da aplicação. Pesquisas conduzidas pela Unicamp demonstraram que formulações nanoencapsuladas de glutamato proporcionam crescimento 25% mais rápido e acúmulo de biomassa 30% superior comparado a formulações convencionais52.
Agricultura de Precisão e Inteligência Artificial
A integração de tecnologias de agricultura de precisão com bioestimulantes naturais está criando oportunidades únicas para otimização da produtividade agrícola através da aplicação dirigida baseada em mapas de variabilidade. Sistemas de monitoramento baseados em drones equipados com sensores multiespectrais podem identificar áreas específicas do campo que se beneficiariam da aplicação dirigida de elicitores específicos154.
Algoritmos de inteligência artificial estão sendo desenvolvidos para predizer a resposta das culturas a diferentes protocolos de bioestimulantes, considerando variáveis como genótipo, condições climáticas, histórico nutricional da área e pressão de pragas e doenças. Esta abordagem personalizada promete aumentar a eficiência dos tratamentos em até 50%, maximizando os benefícios econômicos e ambientais através da aplicação de doses precisas no momento ótimo5453.
Prospecção de Novos Compostos da Biodiversidade Brasileira
A prospecção de novos elicitores naturais a partir da biodiversidade brasileira representa uma oportunidade única para o desenvolvimento de bioestimulantes inovadores com maior eficiência e especificidade. Plantas nativas do Cerrado, Caatinga e Amazônia contêm milhares de compostos bioativos ainda não explorados comercialmente, muitos com potencial superior aos elicitores atualmente utilizados5556.
Pesquisas em andamento em instituições como Embrapa Recursos Genéticos e Biotecnologia, Instituto Nacional de Pesquisas da Amazônia (INPA) e universidades federais já identificaram mais de 200 compostos candidatos com atividade elicitora promissora, incluindo alcaloides, terpenos, flavonoides e peptídeos bioativos. O desenvolvimento destes compostos em produtos comerciais viáveis representará um diferencial competitivo significativo para a agricultura brasileira no cenário mundial5557.
Perspectivas de Mercado e Consolidação Tecnológica
Projeções de Crescimento Setorial
O mercado de bioestimulantes naturais no Brasil apresenta perspectivas excepcionais de crescimento, com projeções conservadoras de atingir R$ 12 bilhões até 2030, representando crescimento médio anual de 15-20%. Esta expansão será impulsionada pela crescente demanda por alimentos sustentáveis, regulamentações mais restritivas para agroquímicos sintéticos e maior conscientização dos produtores sobre os benefícios econômicos e ambientais destas tecnologias24.

A taxa média anual de crescimento do setor brasileiro (21%) é quatro vezes superior à global (5,2%), posicionando o país como líder mundial em inovação e adoção de biotecnologias agrícolas sustentáveis. Dados da Mordor Intelligence projetam que o mercado global de bioestimulantes atingirá US$ 45 bilhões até 2032, com o Brasil respondendo por aproximadamente 15% deste mercado5856.
Integração com Biotecnologias Emergentes
A integração com outras biotecnologias como edição gênica (CRISPR/Cas9), microbioma sintético e agricultura digital criará sinergias que potencializarão ainda mais os benefícios dos bioestimulantes naturais. Plantas editadas para maior responsividade a elicitores específicos, combinadas com formulações precisas baseadas em análise de microbioma, representam o futuro da agricultura sustentável de alta produtividade1554.
Produtores que adotarem estas tecnologias de forma precoce e estratégica estarão melhor posicionados para capitalizar sobre as oportunidades futuras do mercado, com vantagens competitivas sustentáveis baseadas em maior eficiência produtiva, menor impacto ambiental e custos operacionais reduzidos14.
Conclusões e Recomendações Estratégicas
Implementação Gradual e Monitoramento Científico
Para maximizar os benefícios dos bioestimulantes naturais, recomenda-se uma implementação gradual e cientificamente fundamentada que permita adaptação às condições específicas de cada sistema produtivo. Inicie com áreas piloto de 10-20% da propriedade, utilizando protocolos validados por instituições de pesquisa e adaptados para sua região e cultura específica146.
O monitoramento contínuo dos resultados através de indicadores de produtividade, qualidade, sanidade e parâmetros econômicos é essencial para otimização progressiva dos protocolos. Estabeleça parcerias com universidades e institutos de pesquisa que possam fornecer suporte técnico-científico na implementação e ajustes necessários ao longo das safras4347.
Síntese dos Principais Achados
Os compostos naturais com ação epigenética representam uma revolução científica que está transformando a agricultura moderna através da modulação inteligente da expressão gênica vegetal. Moléculas como ácido salicílico, jasmonatos, quitosana, poliaminas e brassinosteróides funcionam como “chaves moleculares” que desbloqueiam genes de resistência, crescimento e adaptação através de mecanismos como metilação do DNA, modificações de histonas e regulação por pequenos RNAs.
Com benefícios econômicos comprovados (ROI médio de 470% em soja, incrementos de produtividade de 15-35%), impactos ambientais positivos (redução de 20-60% no uso de defensivos) e potencial de inovação praticamente ilimitado, estes bioestimulantes naturais oferecem uma trajetória sustentável para o futuro da produção agrícola brasileira, consolidando o país como líder mundial em biotecnologias agrícolas sustentáveis.
Referências
ALCÁZAR, R.; TIBURCIO, A. F. Plant polyamines in stress and development: an emerging area of research in plant biology. Frontiers in Plant Science, v. 9, p. 1-3, 2018.
ANJUM, S. A.; WANG, L. C.; FAROOQ, M.; HUSSAIN, M.; XIE, L. L.; ZOU, C. M. Brassinolide application improves the drought tolerance in maize through modulation of enzymatic antioxidants and leaf gas exchange. Journal of Agronomy and Crop Science, v. 197, n. 3, p. 177-185, 2011.
BIONDI, S.; SCARAMAGLI, S.; CAPITANI, F.; POLACCO, J. C.; TORRIGIANI, P. Polyamines as endogenous signals in the development of Arabidopsis thaliana. Physiologia Plantarum, v. 105, n. 2, p. 285-292, 2022.
CABRERA, J. C.; WÉGRIA, G.; ONDERWATER, R. C. A.; NÁPOLES, M. C. Practical use of oligosaccharins in agriculture. Acta Horticulturae, v. 1009, p. 195-212, 2013.
CASTRO, P. R. C.; KLUGE, R. A.; PERES, L. E. P. Manual de fisiologia vegetal: teoria e prática. Piracicaba: Agronômica Ceres, 1998. 650 p.
CHEN, Z.; SILVA, H.; KLESSIG, D. F. Active oxygen species in the induction of plant systemic acquired resistance by salicylic acid. Science, v. 262, n. 5141, p. 1883-1886, 2009.
CLOUSE, S. D.; SASSE, J. M. Brassinosteroids: essential regulators of plant growth and development. Annual Review of Plant Physiology and Plant Molecular Biology, v. 49, p. 427-451, 1998.
COMPANHIA NACIONAL DE ABASTECIMENTO (CONAB). Acompanhamento da safra brasileira de grãos: v. 11, safra 2024/25, n. 8, oitavo levantamento. Brasília: CONAB, 2025. 95 p.
CREELMAN, R. A.; MULLET, J. E. Biosynthesis and action of jasmonates in plants. Annual Review of Plant Physiology and Plant Molecular Biology, v. 48, p. 355-381, 1997.
DEUNER, C.; BORGES, C. T.; ALMEIDA, A. S.; MENEGHELLO, G. E.; TUNES, L. V. M. Ácido jasmónico como promotor de resistência em plantas. Revista de Ciências Agrárias, v. 38, n. 3, p. 275-281, 2015.
DU JARDIN, P. Plant biostimulants: definition, concept, main categories and regulation. Scientia Horticulturae, v. 196, p. 3-14, 2015.
EMBRAPA. Bioestimulantes e produção de hortaliças. Brasília: Portal Embrapa, 2024. Disponível em: https://www.embrapa.br/busca-de-noticias/-/noticia/14218786/bioestimulantes-e-producao-de-hortalicas. Acesso em: 28 jul. 2025.
FARIDUDDIN, Q.; HAYAT, S.; AHMAD, A. Salicylic acid influences net photosynthetic rate, carboxylation efficiency, nitrate reductase activity, and seed yield in Brassica juncea. Photosynthetica, v. 41, n. 2, p. 281-284, 2009.
FRANCO, A. C. Regulação epigenética da expressão gênica em plantas. Revista Brasileira de Botânica, v. 40, n. 2, p. 289-302, 2017.
FUJIOKA, S.; YOKOTA, T. Biosynthesis and metabolism of brassinosteroids. Annual Review of Plant Biology, v. 54, p. 137-164, 2003.
GOMES, L. F. Desempenho agronômico das culturas da soja e do milho submetidas a aplicação de bioestimulantes. 2021. 87 f. Dissertação (Mestrado em Olericultura) – Instituto Federal Goiano, Rio Verde, 2021.
HASSAN, M. A. Physiological and molecular mechanisms of polyamine biosynthesis and their role in plant responses to abiotic stress. Plant Stress, v. 1, p. 100002, 2020.
HE, X. J.; CHEN, T.; ZHU, J. K. Regulation and function of DNA methylation in plants and animals. Cell Research, v. 21, n. 3, p. 442-465, 2011.
HODGES, D. M. Polyamine oxidases in plant cells: biochemistry and functional roles. In: GROPPA, M. D.; BENAVIDES, M. P. (Ed.). Polyamines: methods and protocols. New York: Humana Press, 2004. p. 137-151.
JAGER, C. E.; SYMONS, G. M.; ROSS, J. J.; REID, J. B. The brassinosteroid growth response in pea is not mediated by changes in gibberellin content. Planta, v. 228, n. 3, p. 473-477, 2008.
KRISHNA, P. Brassinosteroid-mediated stress responses. Journal of Plant Growth Regulation, v. 22, n. 4, p. 289-297, 2003.
KUTSCHERA, U.; WANG, Z. Y. Brassinosteroid action in flowering plants: a Darwinian perspective. Journal of Experimental Botany, v. 63, n. 10, p. 3511-3522, 2012.
LAW, J. A.; JACOBSEN, S. E. Establishing, maintaining and modifying DNA methylation patterns in plants and animals. Nature Reviews Genetics, v. 11, n. 3, p. 204-220, 2010.
LONGATTI, S. M. I. Efeito de promotores de crescimento vegetal no desenvolvimento de mudas de Coffea arabica L. 2012. 96 f. Dissertação (Mestrado em Fitotecnia) – Universidade Federal de Viçosa, Viçosa, 2012.
MCKINSEY & COMPANY. Global farmer insights: sustainable agriculture trends and bioinputs adoption. New York: McKinsey & Company, 2023. 87 p.
MEDEIROS, J. F. Análise econômica do uso de bioestimulantes na cultura da soja. Brazilian Journal of Development, v. 3, n. 4, p. 1245-1258, 2017.
MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO (MAPA). Programa Nacional de Bioinsumos. Brasília: MAPA, 2020. 45 p.
NAHAR, K.; HASANUZZAMAN, M.; ALAM, M. M.; FUJITA, M. Polyamine and nitric oxide crosstalk: antagonistic effects on cadmium toxicity in mung bean plants through upregulating the metal detoxification, antioxidant defense and methylglyoxal detoxification systems. Ecotoxicology and Environmental Safety, v. 126, p. 245-255, 2016.
NELSON, R.; WIESNER-HANKS, T.; WISSER, R.; BALINT-KURTI, P. Navigating complexity to breed disease-resistant crops. Nature Reviews Genetics, v. 19, n. 1, p. 21-33, 2014.
PELEG, Z.; BLUMWALD, E. Hormone balance and abiotic stress tolerance in crop plants. Current Opinion in Plant Biology, v. 14, n. 3, p. 290-295, 2011.
PICHYANGKURA, R.; CHADCHAWAN, S. Biostimulant activity of chitosan in horticulture. Scientia Horticulturae, v. 196, p. 49-65, 2015.
RUSSELL, L. The importance of plant biostimulants in sustainable agriculture. Agricultural Research, v. 2, n. 3, p. 145-158, 2013.
SAINI, S.; SHARMA, I.; KAUR, N.; PATI, P. K. Auxin: a master regulator in plant root development. Plant Cell Reports, v. 32, n. 6, p. 741-757, 2015.
SALLAM, A.; MOUSSA, H. R. Effects of exogenous application of putrescine on the physiological responses of maize (Zea mays L.) plants under drought stress. Alexandria Science Exchange Journal, v. 42, n. 2, p. 583-592, 2021.
SANTINI, J. M. K.; PÁDUA, J. G.; BRITO, C. H.; SILVA, D. A. Efeito de bioestimulante na germinação e desenvolvimento de plântulas de soja. Revista de Ciências Agrárias, v. 58, n. 1, p. 87-92, 2015.
SASSE, J. M. Physiological actions of brassinosteroids: an update. Journal of Plant Growth Regulation, v. 22, n. 4, p. 276-288, 1997.
TAIZ, L.; ZEIGER, E.; MØLLER, I. M.; MURPHY, A. Plant physiology and development. 6. ed. Sunderland: Sinauer Associates, 2017. 761 p.
TAKAHASHI, T.; KAKEHI, J. I. Polyamines: ubiquitous polycations with unique roles in growth and stress responses. Annals of Botany, v. 105, n. 1, p. 1-6, 2010.
TURNER, J. G.; ELLIS, C.; DEVOTO, A. The jasmonate signal pathway. Plant Cell, v. 14, p. S153-S164, 2002.
VASCONCELOS, A. C. F. Uso de bioestimulantes na cultura do milho e da soja. 2006. 111 f. Dissertação (Mestrado em Fitotecnia) – Escola Sup erior de Agricultura “Luiz de Queiroz”, Universidade de São Paulo, Piracicaba, 2006.
VIEIRA, E. L.; CASTRO, P. R. C. Ação de bioestimulante na germinação de sementes, vigor de plântulas, crescimento radicular e produtividade de soja. Revista Brasileira de Sementes, v. 23, n. 2, p. 222-228, 2001.
WASTERNACK, C.; HAUSE, B. Jasmonates: biosynthesis, perception, signal transduction and action in plant stress response, growth and development. Annals of Botany, v. 111, n. 6, p. 1021-1058, 2013.
ZEMACH, A.; GRAFI, G. DNA methylation and chromatin structure in plants. Current Opinion in Plant Biology, v. 9, n. 5, p. 501-506, 2006




0 comentários