Você já parou para pensar como suas culturas conseguem sobreviver e manter a produtividade mesmo em períodos de estiagem prolongada? A resposta está em um processo fundamental da fisiologia vegetal que, quando bem compreendido, pode revolucionar o manejo agrícola: a osmorregulação 12. Este mecanismo sofisticado permite que as plantas mantenham o equilíbrio hídrico celular e a funcionalidade metabólica mesmo sob condições de estresse, sendo crucial para a sustentabilidade da agricultura brasileira em cenários de mudanças climáticas 34.
No contexto do agronegócio nacional, onde mais de 95% da soja é cultivada em regime de sequeiro e os períodos de estiagem se tornam cada vez mais frequentes, compreender e aplicar os princípios da osmorregulação representa uma estratégia fundamental para maximizar a eficiência produtiva 56. A osmorregulação não é apenas um conceito teórico da fisiologia vegetal, mas uma ferramenta prática que pode ser otimizada através de técnicas de manejo, seleção de cultivares e uso de tecnologias específicas 78.
Este artigo apresentará os fundamentos científicos da osmorregulação vegetal, seus mecanismos celulares e moleculares, e principalmente suas aplicações práticas na agricultura 49. Você compreenderá como os processos de ajuste osmótico influenciam diretamente a produtividade das principais culturas brasileiras e descobrirá estratégias baseadas em evidências científicas para otimizar este processo em seus sistemas produtivos, resultando em maior tolerância ao estresse hídrico e sustentabilidade agrícola 210.
Fundamentos da Osmorregulação Vegetal
O que é Osmorregulação: Definição Técnica e Aplicação Prática
A osmorregulação é o mecanismo fisiológico pelo qual as plantas controlam a pressão osmótica intracelular, mantendo o equilíbrio de fluidos e eletrólitos em relação ao ambiente externo 111. Este processo fundamental permite que as células vegetais regulem o volume celular e mantenham a homeostase hídrica, especialmente em condições de estresse ambiental 9. Segundo Blum (2017), a osmorregulação envolve a capacidade das células vegetais de acumular solutos orgânicos e inorgânicos intracelularmente para reduzir o potencial hídrico durante períodos de estresse osmótico 2.
Na prática agrícola, a osmorregulação traduz-se na capacidade das culturas de manter a turgescência celular e a funcionalidade metabólica mesmo quando a disponibilidade hídrica é limitada 1213. Este mecanismo é particularmente relevante para o agronegócio brasileiro, onde culturas como soja, milho e café enfrentam períodos de déficit hídrico que podem comprometer significativamente a produtividade 1415. O entendimento deste processo permite aos produtores implementar estratégias de manejo que potencializem a capacidade osmorreguladora das plantas, resultando em maior estabilidade produtiva 1617.
O processo osmorregulador atua através da modificação controlada da concentração de solutos no interior das células, criando gradientes osmóticos favoráveis à absorção e retenção de água 1811. Esta estratégia biológica é especialmente importante em regiões onde a precipitação é irregular ou insuficiente, permitindo que as plantas mantenham processos fisiológicos essenciais como fotossíntese, transporte de nutrientes e crescimento celular mesmo sob condições de estresse hídrico moderado a severo 1920.
Componentes do Potencial Hídrico nas Plantas
O potencial hídrico (ψw) representa a energia livre da água e constitui o principal determinante do movimento de água nas plantas 2112. Este parâmetro fundamental é composto por três componentes principais: o potencial osmótico (ψs), o potencial de pressão ou pressão de turgor (ψp) e o potencial mátrico (ψm) 2219. A equação básica que descreve o potencial hídrico é expressa como: ψw = ψs + ψp + ψm 12.
O potencial osmótico resulta da presença de solutos dissolvidos na solução celular e apresenta sempre valores negativos, pois a adição de solutos reduz o potencial hídrico da água pura 2111. Nas plantas, este componente é fundamental para a osmorregulação, uma vez que o acúmulo controlado de solutos compatíveis permite reduzir o potencial osmótico e favorecer a absorção de água 2324. O potencial de pressão corresponde à pressão física exercida pelo conteúdo celular contra a parede celular, sendo positivo em células túrgidas e fundamental para a manutenção da rigidez estrutural da planta 2225.
Na agricultura prática, o monitoramento do potencial hídrico fornece informações precisas sobre o status hídrico das culturas 2627. Valores ideais para a maioria das plantas cultivadas situam-se entre -0,002 e -0,1 MPa, sendo que potenciais abaixo de -1,0 MPa indicam estresse hídrico significativo 2128. A compreensão destes componentes permite aos técnicos avaliar as condições hídricas das culturas e implementar estratégias de manejo que otimizem a osmorregulação, como ajustes na irrigação, aplicação de osmoprotectores e seleção de cultivares com maior capacidade de ajuste osmótico 729.
Diferença entre Osmoconformadores e Osmorreguladores
As plantas podem ser classificadas em duas categorias principais quanto à estratégia osmorreguladora: osmoconformadores e osmorreguladores 9. Os osmoconformadores são organismos que adaptam a pressão osmótica interna às variações do meio externo, não mantendo controle rigoroso sobre sua pressão osmótica intracelular 13. Esta estratégia é mais comum em invertebrados marinhos, sendo relativamente rara em plantas terrestres 9.
A maioria das plantas cultivadas são osmorreguladores, mantendo pressão osmótica interna relativamente constante independentemente das variações ambientais 211. Esta capacidade osmorreguladora é fundamental para o sucesso das culturas agrícolas, permitindo que mantenham a funcionalidade celular e a produtividade mesmo em condições de estresse hídrico ou salino 288. Plantas osmorreguladores desenvolveram sofisticados mecanismos celulares e moleculares para controlar ativamente o movimento de água e solutos através das membranas celulares 3031.
No contexto agrícola brasileiro, culturas como soja e milho demonstram capacidade osmorreguladora significativa, permitindo cultivo bem-sucedido em regiões do Cerrado onde a disponibilidade hídrica é sazonal 1014. Esta característica é particularmente importante para sistemas de produção em sequeiro, onde a capacidade de ajuste osmótico pode determinar a diferença entre produtividade satisfatória e perdas significativas durante períodos de estiagem 515. O melhoramento genético tem focado na seleção de genótipos com maior capacidade osmorreguladora, resultando em cultivares mais adaptadas às condições ambientais variáveis típicas da agricultura tropical 732.
Mecanismos Celulares da Osmorregulação
Papel dos Vacúolos no Controle Osmótico
Os vacúolos representam os principais compartimentos celulares responsáveis pela osmorregulação em plantas, ocupando até 90% do volume celular em células maduras 2511. Estes organelos funcionam como reservatórios dinâmicos de água e solutos, permitindo às plantas regular rapidamente a pressão osmótica intracelular em resposta às variações ambientais 1813. O controle vacuolar da homeostase osmótica envolve o transporte seletivo de íons, açúcares e aminoácidos através da membrana tonoplástica, criando gradientes osmóticos que favorecem a absorção e retenção de água 2311.
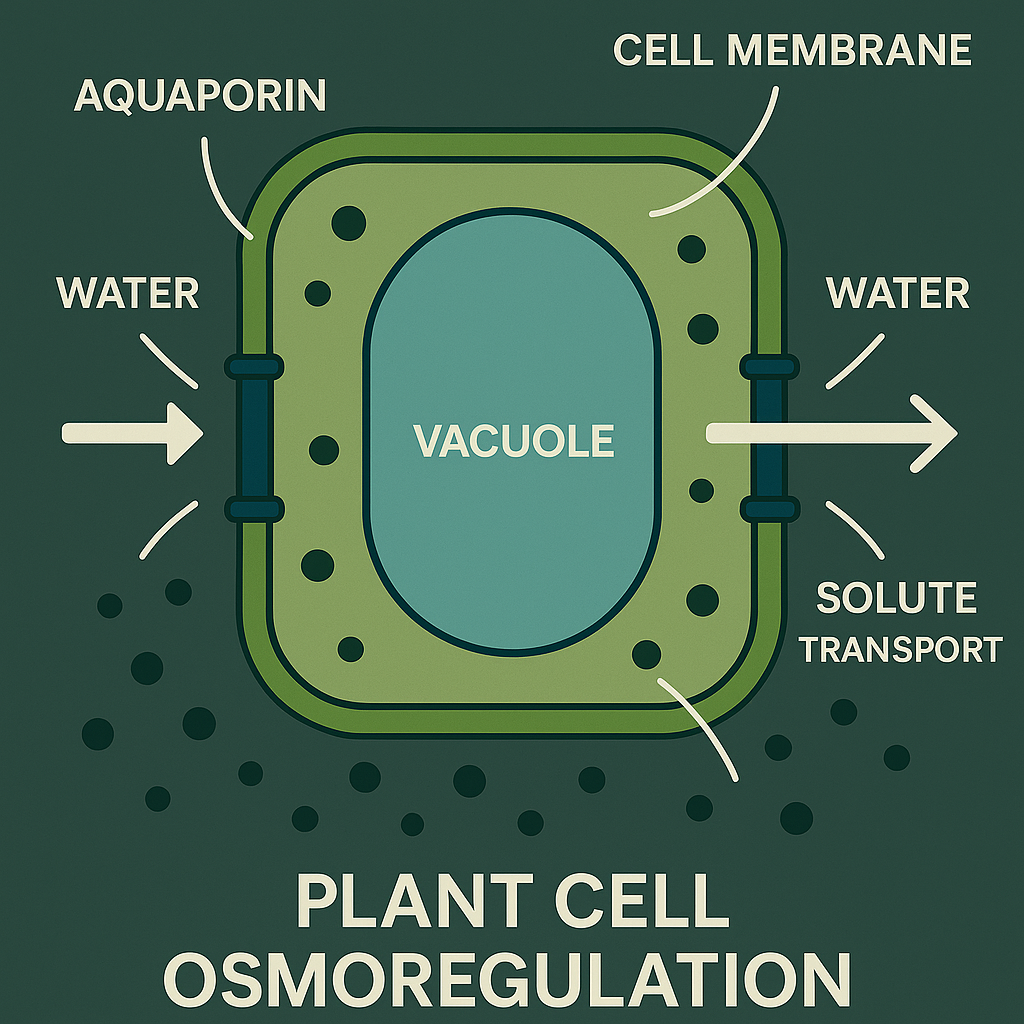
Esquema celular da osmorregulação em plantas mostrando mecanismos de transporte de água e solutos
Durante o estresse hídrico, os vacúolos acumulam solutos compatíveis como prolina, glicina betaína e açúcares solúveis, reduzindo o potencial osmótico celular sem comprometer a funcionalidade enzimática 3334. Estudos demonstram que plantas com maior capacidade de acumulação vacuolar de osmólitos apresentam tolerância superior ao déficit hídrico, mantendo a pressão de turgor e a expansão celular mesmo sob condições limitantes 3528. Esta estratégia é particularmente evidente em culturas adaptadas ao clima semiárido, onde a capacidade de osmorregulação vacuolar determina a sobrevivência e produtividade 3637.
A regulação do pH vacuolar constitui outro aspecto crucial da osmorregulação, influenciando a atividade de transportadores iônicos e a solubilidade de compostos orgânicos 1811. O sistema de H+-ATPase e H+-PPase vacuolar mantém o gradiente eletroquímico necessário para o transporte ativo de solutos, permitindo o acúmulo de concentrações elevadas de osmólitos sem toxicidade celular 11. Esta arquitetura bioquímica possibilita às plantas implementar estratégias de economia energética durante o estresse, concentrando recursos na manutenção de processos vitais 3417.
Função dos Estômatos na Regulação Hídrica
Os estômatos constituem os principais reguladores da perda de água nas plantas, controlando simultaneamente a entrada de CO₂ para fotossíntese e a saída de vapor d’água por transpiração 2619. O controle estomático representa o primeiro mecanismo de resposta ao estresse hídrico, permitindo às plantas equilibrar a demanda evaporativa atmosférica com a disponibilidade hídrica do solo 420. A regulação estomática é mediada por complexos sistemas de sinalização que integram informações sobre o status hídrico da planta, concentração de CO₂ atmosférico e condições ambientais 2619.
Durante períodos de déficit hídrico, o fechamento estomático reduz a condutância estomática e a transpiração, conservando a água disponível nos tecidos vegetais 1910. Este processo é controlado pela síntese e acumulação de ácido abscísico (ABA), hormônio que promove a saída de íons K+ das células-guarda, resultando na perda de turgor e fechamento dos poros estomáticos 2620. A sensibilidade estomática ao ABA varia entre espécies e cultivares, constituindo um importante critério de seleção para tolerância à seca 67.
A eficiência da regulação estomática influencia diretamente a eficiência do uso da água (EUA), parâmetro crucial para a sustentabilidade da agricultura em ambientes com limitação hídrica 1610. Cultivares com maior capacidade de regulação estomática mantêm fotossíntese ativa por períodos mais prolongados durante o estresse, resultando em menor redução de produtividade 520. Esta característica é especialmente valorizada no melhoramento de culturas para regiões semiáridas, onde a capacidade de conservação hídrica determina o sucesso agronômico 1415.
Aquaporinas: Transportadores Multifuncionais de Água
As aquaporinas constituem uma família de proteínas de membrana especializadas no transporte de água e pequenas moléculas neutras através das membranas celulares 3031. Estas proteínas canais facilitam o movimento rápido e seletivo de água, desempenhando papel fundamental na regulação da permeabilidade hídrica celular e na resposta ao estresse osmótico 3138. Em plantas, as aquaporinas ocorrem em múltiplas isoformas com localização celular específica, incluindo membrana plasmática, tonoplasto, retículo endoplasmático e plastídios 30.
A regulação das aquaporinas envolve mecanismos complexos de modificação pós-traducional, incluindo fosforilação, que controlam a atividade e localização subcelular destas proteínas 3038. Durante o estresse hídrico, a fosforilação de aquaporinas específicas aumenta a permeabilidade hídrica das membranas, facilitando o transporte de água para compartimentos celulares estratégicos 3138. Estudos em milho demonstram que plantas micorrizadas mantêm maior atividade de aquaporinas durante o déficit hídrico, preservando a condutividade hidráulica radicular e a capacidade fotossintética 38.
As aquaporinas também transportam solutos importantes para a osmorregulação, incluindo glicerol, ureia e peróxido de hidrogênio, integrando o transporte hídrico com o metabolismo celular 3031. Esta multifuncionalidade permite às plantas coordenar a homeostase hídrica com processos de sinalização e detoxificação, otimizando a resposta adaptativa ao estresse 31. O melhoramento genético tem explorado a variabilidade natural na expressão e atividade de aquaporinas para desenvolver cultivares com maior tolerância ao estresse hídrico 739.
Estratégias de Ajuste Osmótico
Acumulação de Solutos Compatíveis
A acumulação de solutos compatíveis representa uma das estratégias mais eficazes de ajuste osmótico em plantas, permitindo a manutenção da pressão de turgor celular sem interferir na funcionalidade enzimática 124. Estes compostos, também denominados osmoprotetores, incluem aminoácidos livres, açúcares solúveis, álcoois de açúcar e compostos quaternários de amônio que se acumulam no citoplasma durante condições de estresse 3323. A síntese e acumulação destes solutos constitui um mecanismo altamente conservado evolutivamente, presente desde microorganismos até plantas superiores 2324.
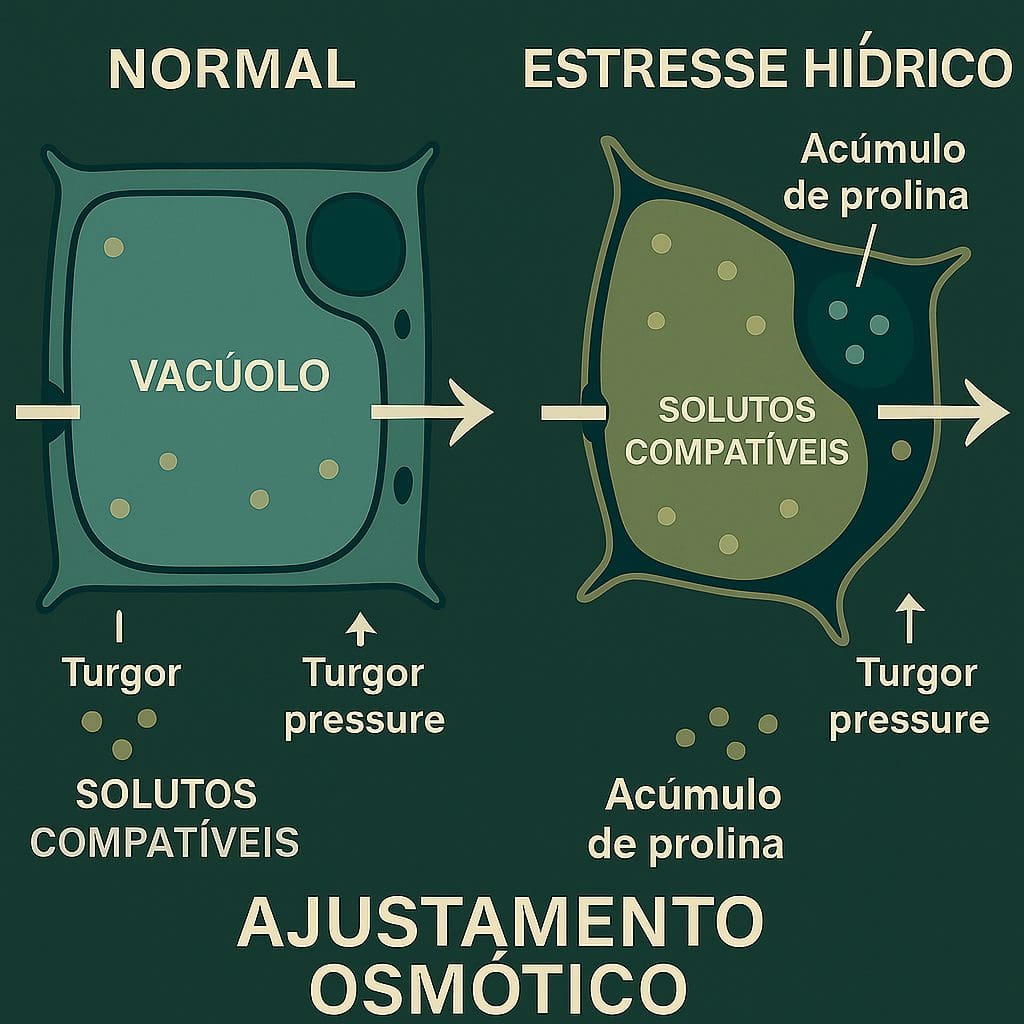
Comparação dos mecanismos de ajuste osmótico em condições normais vs estresse hídrico
A eficácia dos solutos compatíveis reside na sua capacidade de reduzir o potencial osmótico celular sem perturbar a estrutura proteica ou a atividade enzimática, mesmo em concentrações elevadas 24. Estudos bioquímicos demonstram que estes compostos são excluídos da esfera de hidratação de proteínas, estabilizando a conformação nativa e protegendo contra a desnaturação induzida pelo estresse 24. Esta propriedade permite às plantas acumular concentrações milimolares de osmoprotetores sem comprometer o metabolismo celular 3334.
A diversidade de solutos compatíveis reflete adaptações específicas a diferentes tipos de estresse ambiental 3634. Plantas halófitas acumulam preferencialmente glicina betaína e sorbitol, enquanto espécies de ambientes secos privilegiam a síntese de prolina e trealose 3540. Esta especialização metabólica indica que a seleção de cultivares para ambientes específicos deve considerar o perfil de osmólitos compatíveis, otimizando a resposta adaptativa 287.
Osmólitos: Prolina, Glicina Betaína e Açúcares Solúveis
A prolina constitui o osmólito mais amplamente estudado e utilizado por plantas sob estresse hídrico e salino 3541. Este aminoácido livre acumula-se rapidamente no citoplasma e cloroplastos durante o estresse, podendo atingir concentrações de até 80% do pool total de aminoácidos 4110. A síntese de prolina é catalisada pela enzima Δ¹-pirrolina-5-carboxilato sintase (P5CS), cuja expressão é fortemente induzida por déficit hídrico e sinais hormonais como ABA 41. Estudos em soja selvagem (Glycine soja) demonstram que genótipos tolerantes à seca apresentam maior capacidade de síntese e acumulação de prolina, correlacionando-se com menor dano oxidativo e manutenção da fotossíntese 10.
A glicina betaína representa outro osmoprotetor crucial, especialmente em plantas da família Chenopodiaceae e algumas gramíneas 4024. Este composto quaternário de amônio é sintetizado a partir da colina através das enzimas colina monooxigenase e betaína aldeído desidrogenase 40. A aplicação exógena de glicina betaína demonstra eficácia significativa na melhoria da tolerância osmótica, aumentando a retenção hídrica e estabilizando membranas celulares 3328. Pesquisas em Solanaceae revelam que a aplicação foliar de glicina betaína pode aumentar a tolerância salina em até 49% em alguns genótipos 33.
Os açúcares solúveis, incluindo sacarose, glucose, frutose e trealose, funcionam simultaneamente como osmólitos e fontes de energia durante o estresse 3634. No Cerrado brasileiro, plantas herbáceas acumulam frutanos do tipo inulina e levana como reservas de carboidratos que conferem proteção contra seca e fogo 36. A trealose, embora presente em concentrações menores, demonstra eficácia excepcional na estabilização de proteínas e membranas 3417. O manejo agronômico pode influenciar o acúmulo de açúcares solúveis através da nutrição mineral, especialmente potássio, que facilita a síntese e transporte de carboidratos 16.
Compartimentalização de Íons Inorgânicos
A compartimentalização de íons inorgânicos constitui uma estratégia economicamente vantajosa de ajuste osmótico, utilizando solutos abundantes e de baixo custo metabólico 1842. Esta estratégia envolve o acúmulo seletivo de íons K⁺, Na⁺ e Cl⁻ em compartimentos celulares específicos, principalmente vacúolos, evitando interferência com processos enzimáticos citosólicos 1117. O transporte ativo destes íons é mediado por antiportadores Na⁺/H⁺ e Cl⁻/H⁺ localizados no tonoplasto, criando gradientes iônicos que contribuem significativamente para o ajuste osmótico 1811.
A eficiência da compartimentalização iônica varia entre espécies e está relacionada com a tolerância salina natural 428.Estudos em Carex duriuscula demonstram que esta espécie utiliza preferencialmente íons inorgânicos para ajuste osmótico, aumentando a absorção de K⁺, Na⁺ e Cl⁻ durante o estresse hídrico 17. Esta estratégia resulta em menor gasto energético comparado à síntese de solutos orgânicos, permitindo maior eficiência na utilização de recursos durante períodos limitantes 1117.
A regulação da compartimentalização iônica envolve complexos mecanismos de sinalização que coordenam o transporte de íons com o status energético celular 119. A atividade dos antiportadores vacuolares é modulada por modificações pós-traducionais e pela disponibilidade de ATP e fosfoenolpiruvato 18. Em quinoa, a combinação de compartimentalização iônica com acumulação de solutos orgânicos proporciona tolerância excepcional ao estresse salino e hídrico combinados 43. Esta plasticidade metabólica sugere que o melhoramento genético pode explorar diferentes estratégias osmoreguladoras para otimizar a adaptação a ambientes específicos 78.
Osmorregulação sob Estresse Hídrico
Mecanismos de Tolerância à Seca
A tolerância à seca em plantas resulta da integração de múltiplos mecanismos fisiológicos e bioquímicos que permitem a manutenção da funcionalidade celular sob condições de déficit hídrico 420. Estes mecanismos podem ser classificados em três categorias principais: escape à seca, evitação da seca e tolerância à desidratação 44. O escape envolve completar o ciclo de vida antes do estabelecimento do estresse severo, enquanto a evitação refere-se à manutenção de alto status hídrico através de adaptações morfológicas e fisiológicas 4420.
A tolerância à desidratação constitui o mecanismo mais complexo e relevante para culturas agrícolas, envolvendo a capacidade de manter processos vitais mesmo com baixo conteúdo hídrico celular 1020. Este processo inclui a síntese de proteínas de choque térmico, acumulação de antioxidantes e reorganização do metabolismo celular para conservar energia e recursos 4510. Estudos em café (Coffea canephora) demonstram que plantas expostas a múltiplos eventos de seca desenvolvem aclimatação metabólica, exibindo maior atividade de RuBisCO e enzimas antioxidantes em episódios subsequentes de estresse 20.
A expressão gênica durante o estresse hídrico é coordenada por fatores de transcrição específicos, incluindo as famílias DREB, AREB, NAC e MYB 446. Estes reguladores maestros ativam cascatas de genes responsáveis pela síntese de osmoprotetores, enzimas antioxidantes e proteínas de proteção 447. O pathway ICE-CBF-COR, inicialmente caracterizado para tolerância ao frio, também contribui para a resposta ao estresse hídrico através da síntese de substâncias osmoreguladoras 45. Esta sobreposição de vias de sinalização permite respostas coordenadas a múltiplos estresses abióticos 448.
Ajuste Osmótico em Condições de Déficit Hídrico
O ajuste osmótico ativo representa a resposta mais imediata e eficaz ao déficit hídrico, permitindo às plantas manter a absorção de água mesmo com potenciais hídricos do solo progressivamente mais negativos 221. Este processo envolve a síntese e acumulação rápida de solutos compatíveis, reduzindo o potencial osmótico celular em 0,2 a 2,0 MPa dependendo da espécie e severidade do estresse 228. Meta-análises abrangendo 26 estudos e 12 culturas diferentes demonstram correlação positiva e significativa entre capacidade de ajuste osmótico e produtividade sob estresse hídrico em 24 dos 26 casos analisados 2.
A magnitude do ajuste osmótico varia consideravelmente entre espécies e cultivares, constituindo um importante critério de seleção para tolerância à seca 287. Genótipos de pistache tolerantes apresentam reduções no potencial osmótico de até -1,61 MPa nas folhas durante o estresse, enquanto genótipos sensíveis alcançam apenas -0,93 MPa 28. Esta diferença na capacidade osmorreguladora correlaciona-se diretamente com a manutenção do conteúdo relativo de água e a recuperação pós-estresse 286.
A cinética do ajuste osmótico também influencia a eficácia da resposta adaptativa 241. Ajustes rápidos, ocorrendo nas primeiras 24-48 horas após o início do estresse, são mais eficazes na prevenção de danos celulares comparados a respostas tardias 4110. Esta velocidade de resposta está relacionada com a atividade constitutiva de enzimas-chave da síntese de osmólitos e a sensibilidade dos sistemas de detecção de estresse 41. O melhoramento genético tem focado na seleção de genótipos com resposta osmoregulatória precoce e intensa 732.
Manutenção da Pressão de Turgor
A manutenção da pressão de turgor constitui o objetivo final dos mecanismos de ajuste osmótico, sendo essencial para a continuidade de processos dependentes de pressão como expansão celular, abertura estomática e transporte de longa distância 2212. A pressão de turgor é determinada pela diferença entre o potencial osmótico e o potencial hídrico celular, podendo ser preservada através da redução do potencial osmótico via acumulação de solutos 1225. Esta manutenção permite às plantas continuar crescimento e desenvolvimento mesmo sob condições de estresse hídrico moderado 2517.
A capacidade de manutenção de turgor varia significativamente entre órgãos vegetais e estágios de desenvolvimento 2125.Folhas jovens em expansão priorizam a manutenção de turgor para continuar crescimento, enquanto folhas maduras podem tolerar reduções maiores de pressão 25. Raízes frequentemente mantêm turgor mais elevado que a parte aérea, facilitando a absorção contínua de água do solo 2138. Esta hierarquia de prioridades na manutenção de turgor reflete estratégias evolutivas de otimização de recursos durante o estresse 44.
Entretanto, estudos recentes questionam a eficácia isolada da manutenção de turgor para tolerância à seca 21. Pesquisas com múltiplas espécies demonstram que reduções na condutividade hidráulica radicular podem neutralizar os benefícios do ajuste osmótico 21. Em oliveiras, a redução de 2,5 vezes na condutividade hidráulica cancela completamente o efeito positivo do ajuste osmótico na manutenção de turgor 21. Esta descoberta enfatiza a importância de abordagens integradas na seleção para tolerância à seca, considerando tanto capacidade osmoregulatória quanto eficiência do sistema vascular 727.
Aplicações na Agricultura Brasileira
Cultivos Tolerantes à Seca: Soja, Milho e Café
A soja (Glycine max) demonstra notável plasticidade osmoregulatória, característica que contribui para seu sucesso na agricultura brasileira de sequeiro 105. Estudos comparativos entre cultivares comerciais revelam diferenças significativas na capacidade de ajuste osmótico, com genótipos tolerantes como BRS 7280RR apresentando maior eficiência no uso da água e estabilidade produtiva 56. A tolerância osmótica em soja está associada à manutenção da turgidez celular via acumulação de solutos compatíveis, permitindo que cultivares como R01-416F preservem função celular mesmo sob déficit hídrico severo 6.

Aplicação prática da osmorregulação na agricultura brasileira: culturas tolerantes vs sensíveis à seca
O milho (Zea mays) apresenta sensibilidade variável ao déficit hídrico dependendo do estágio fenológico, sendo o florescimento o período mais crítico 1415. Genótipos brasileiros podem ser classificados em dois grupos quanto à resistência hídrica: aqueles com resistência normal (Ky = 1,4-1,5 durante florescimento) e genótipos de alta resistência (Ky = 0,7-1,2) 14. Esta variabilidade genética oferece oportunidades para seleção de materiais mais adaptados às condições semiáridas 1532. Estudos no Nordeste brasileiro demonstram que híbridos como AG 1051 mantêm produtividade satisfatória mesmo com evapotranspiração de 300 mm durante o ciclo de 77 dias 15.
O café (Coffea canephora) desenvolveu sofisticados mecanismos de tolerância à seca através de múltiplas exposições a estresse hídrico 20. Plantas pré-condicionadas apresentam maior atividade fotossintética, eficiência de RuBisCO e capacidade antioxidante durante episódios subsequentes de seca 20. Esta memória metabólica permite ao cafeeiro otimizar recursos e manter produtividade em ambientes com estresse hídrico recorrente 4420. O melhoramento de café tem explorado esta característica para desenvolver cultivares mais resilientes a variações climáticas 44.
Estratégias de Manejo para Otimização Hídrica
A aplicação foliar de osmoprotectores constitui uma estratégia promissora para otimizar a capacidade osmorreguladora das culturas 3329. Aplicações de prolina e glicina betaína demonstram eficácia na melhoria da tolerância osmótica, com incrementos de 25-35% na tolerância à seca em diversos cultivos 3329. A melatonina emerge como outro bioestimulante eficaz, promovendo acúmulo de prolina (26% em seca), clorofila (16%) e conteúdo relativo de água (10%) quando aplicada foliarmente 48.
O manejo nutricional, particularmente de potássio, influencia significativamente a capacidade osmorreguladora 16.Aplicações de K₂O de 120 kg ha⁻¹ em gergelim resultam em maior atividade antioxidante, menor peroxidação lipídica e maior acúmulo de prolina e proteínas solúveis durante estresse hídrico 16. Esta estratégia nutricional otimiza tanto a produção de osmólitos orgânicos quanto a compartimentalização de íons inorgânicos 1617.
O condicionamento osmótico de sementes oferece vantagens na germinação sob estresse 4950. Tratamentos com polietilenoglicol (PEG 6000) em concentrações específicas melhoram a germinação e vigor de plântulas em condições limitantes 4950. Estudos com aveia forrageira identificam genótipos como Teporaca, Menonita e Babicora com tolerância osmótica superior, apresentando crescimento radicular até 346% superior aos controles em condições de estresse 50.
Impacto na Produtividade e Sustentabilidade
A implementação de estratégias baseadas em osmorregulação resulta em benefícios mensuráveis na produtividade e sustentabilidade agrícola 229. Bioestimulantes híbridos combinando osmoprotetores e micronutrientes demonstram incrementos de 25-30% na produtividade sob condições de estresse hídrico 29. Estes resultados sugerem potencial significativo para redução de perdas econômicas associadas à seca, que custam bilhões de dólares anualmente à agricultura global 29.
A seleção de cultivares com maior capacidade osmorreguladora contribui para a agricultura de baixo carbono através da redução da necessidade de irrigação 3751. Sistemas de produção no Nordeste brasileiro demonstram que tecnologias de irrigação eficiente, combinadas com cultivares tolerantes, reduzem vulnerabilidade climática e promovem adaptação inadvertida às mudanças climáticas 3751. Esta abordagem integrada oferece soluções sustentáveis para intensificação agrícola em ambientes com limitação hídrica 51.
O monitoramento de estresse hídrico através de tecnologias de agricultura de precisão permite otimização temporal das estratégias osmoreguladoras 2752. Sistemas baseados em emissão acústica, radiofrequência e sensores de umidade facilitam detecção precoce de estresse, permitindo intervenções proativas 2752. A integração destas tecnologias com conhecimento fisiológico de osmorregulação promove eficiência de recursos e sustentabilidade produtiva 52.
Estudos de Caso e Evidências Científicas
Pesquisas em Condições Brasileiras
Pesquisas conduzidas no Cerrado brasileiro com soja demonstram variabilidade significativa na capacidade osmorreguladora entre cultivares comerciais 56. O estudo comparativo entre seis cultivares sob quatro regimes hídricos (31%, 44%, 64% e 100% da evapotranspiração) revelou que cultivares como BRS 7280RR e NA 5909 RG mantêm estabilidade produtiva e maior eficiência no uso da água 5. Estas cultivares apresentam menor redução na área foliar e manutenção de índices de vegetação favoráveis mesmo sob déficit hídrico severo 5.
Avaliações de genótipos de soja tolerantes à fixação de nitrogênio sob seca (NFDT) identificaram R01-581F como superior na manutenção de atributos fotossintéticos e concentrações de nutrientes 6. Este genótipo mantém taxas fotossintéticas e transpiratórias estáveis, além de níveis de CO₂ intercelular elevados durante estresse hídrico 6. A tolerância está associada à manutenção da turgidez celular via ajuste osmótico, evidenciada pelo acúmulo de açúcares solúveis totais em nódulos e ureídeos em folhas 6.
Estudos com milho no semiárido brasileiro caracterizaram 26 genótipos quanto à sensibilidade hídrica usando modelos agrometeorológicos simples 14. Os resultados permitiram classificação em grupos de resistência normal (Ky = 2,15) e alta resistência (Ky = 1,56) para o ciclo total 14. A sensibilidade é maior durante florescimento, seguida por crescimento vegetativo e formação de rendimento 14. Durante maturação, os genótipos apresentam menor sensibilidade, evidenciando adaptações específicas aos estágios fenológicos 1415.
Resultados Quantificados de Campo
Experimentos de campo com aplicação de bioestimulantes demonstram resultados quantificados promissores para otimização da osmorregulação 4816. Aplicações foliares de melatonina (100 µM) em tomateiro sob estresse hídrico e térmico combinados resultam em incrementos de 16% no conteúdo de clorofila total, 16% na relação Fv/Fm e 10% no conteúdo relativo de água 48. O tratamento também promove aumento de 26% na concentração de prolina e melhoria significativa nas características estomáticas 48.
Ensaios com gergelim sob diferentes níveis de potássio (0, 60 e 120 kg ha⁻¹) e estresse hídrico demonstram que a dose de 120 kg ha⁻¹ otimiza a resposta osmoregulatória 16. Plantas tratadas apresentam menor peroxidação lipídica, maior atividade de superóxido dismutase e glutationa redutase, além de acúmulo aumentado de prolina e proteínas solúveis 16.A análise quantitativa revela que prolina e proteínas solúveis dominam a regulação osmótica aos 3 e 6 dias de estresse, respectivamente 16.
Pesquisas com pistache identificam diferenças marcantes entre genótipos quanto à capacidade osmorreguladora 28. O clone C9-4 (tolerante) apresenta aumento de 29,5% na prolina foliar e 41,5% na prolina radicular, enquanto C8-3 (sensível) mostra incrementos de apenas 6% e 11%, respectivamente 28. O genótipo tolerante mantém 94% do conteúdo relativo de água, enquanto o sensível apresenta redução para 12% 28. Estes dados quantificados demonstram a correlação direta entre capacidade osmoregulatória e tolerância ao estresse 28.
Aplicação Prática em Sistemas Produtivos
A implementação prática de estratégias osmoreguladoras em sistemas produtivos brasileiros demonstra viabilidade técnica e econômica 3751. Experiências no Nordeste durante a seca de 2011-2013 revelam que combinação de irrigação eficiente, diversificação de renda e tecnologias adaptativas reduz vulnerabilidade climática 3751. Produtores adotaram sistemas de gotejamento principalmente para reduzir erosão e necessidades de mão-de-obra, obtendo benefício adicional na economia hídrica 51.
Programas de melhoramento incorporam marcadores moleculares associados à tolerância osmótica para acelerar seleção 78. Análises de GWAS em soja identificam 1.841 SNPs significativos associados à tolerância salina durante germinação, distribuídos nos cromossomos 2, 5, 6 e 20 7. Estes marcadores associam-se a genes candidatos com funções essenciais na regulação osmótica, mitigação de estresse oxidativo e transporte de íons 7. O desenvolvimento de marcadores KASP baseados nestes SNPs facilita seleção assistida para tolerância osmótica 7.
Biofertilizantes biofilmados (BFBF) demonstram eficácia na indução de tolerância à seca em arroz através de mecanismos osmoregulatórios 39. O tratamento melhora crescimento radicular, reduz enrolamento foliar e promove retenção hídrica na rizosfera 39. A alta concentração de substâncias exopoliméricas dos BFBF contribui para retenção de água no solo, auxiliando variedades sensíveis como AT 307 a superar estresse hídrico na fase vegetativa 39. Esta tecnologia oferece alternativa biológica para melhoria da tolerância osmótica em sistemas sustentáveis 39.
Conclusão e Perspectivas Futuras
A osmorregulação em plantas representa um conjunto integrado de mecanismos fisiológicos e bioquímicos fundamentais para a sustentabilidade da agricultura brasileira em cenários de mudanças climáticas 42. O domínio destes processos oferece oportunidades concretas para otimização da produtividade através de estratégias de manejo, melhoramento genético e aplicação de tecnologias específicas 729. As evidências científicas demonstram correlação positiva entre capacidade osmorreguladora e estabilidade produtiva sob estresse hídrico, validando investimentos em pesquisa e desenvolvimento nesta área 228.
As perspectivas futuras incluem desenvolvimento de cultivares inteligentes com capacidade osmorreguladora aprimorada através de edição genética CRISPR/Cas9 e seleção assistida por marcadores 732. A integração de tecnologias de agricultura de precisão para monitoramento em tempo real do status osmótico das culturas permitirá intervenções mais eficazes e oportunas 2752. O desenvolvimento de bioestimulantes específicos e sistemas de liberação controlada promete revolucionar a aplicação prática de osmoprotectores 29.
A consolidação do conhecimento sobre osmorregulação como ferramenta de manejo agronômico contribuirá significativamente para a segurança alimentar global e sustentabilidade da agricultura tropical 5129. O investimento contínuo em pesquisa aplicada, transferência de tecnologia e capacitação técnica garantirá que estes avanços científicos sejam efetivamente traduzidos em benefícios práticos para o agronegócio brasileiro 3732.
Referências Bibliográficas
ABNT. NBR 6023: informação e documentação: referências: elaboração. Rio de Janeiro: ABNT, 2018. Disponível em: https://www.ufpe.br/documents/40070/1837975/ABNT+NBR+6023+2018+(1).pdf/3021f721-5be8-4e6d-951b-fa354dc490ed. Acesso em: 29 jun. 2025.
AHMED, I. et al. Melatonin as an emerging regulator of plant abiotic stress tolerance. Journal of Plant Growth Regulation, v. 40, p. 1951-1964, 2021. DOI: 10.1007/s00344-022-10650-0. Disponível em: https://link.springer.com/10.1007/s00344-022-10650-0. Acesso em: 29 jun. 2025.
AKRAM, N. A. et al. Glycine betaine: a potential osmolyte in conferring salt tolerance in plants. In: HOSSAIN, M. A. et al. (ed.). Plant-environment interaction: responses and approaches to mitigate stress. Cham: Springer, 2019. p. 1-22. DOI: 10.1007/978-3-030-06118-0_8. Disponível em: http://link.springer.com/10.1007/978-3-030-06118-0_8. Acesso em: 29 jun. 2025.
AKRAM, N. A.; ASHRAF, M.; AL-QURAINY, F. Photosynthetic efficiency in plants under salt stress. In: AFTAB, T.; HAKEEM, K. R. (ed.). Photosynthesis, respiration, and climate change. Cham: Springer, 2021. p. 147-164. DOI: 10.1007/978-94-011-4661-6_117. Disponível em: http://link.springer.com/10.1007/978-94-011-4661-6_117. Acesso em: 29 jun. 2025.
ALAM, M. M. et al. Biofilmed biofertilizers (BFBFs) induce drought tolerance of rice (Oryza sativa L.). Rhizosphere, v. 10, p. 100147, 2019. Disponível em: https://researchoutput.csu.edu.au/en/publications/biofilmed-biofertilizers-induce-drought-tolerance-of-rice. Acesso em: 29 jun. 2025.
ANDRADE, D. P.; SENTELHAS, P. C. Viabilidade do plantio de segunda safra de milho em diferentes épocas no Mato Grosso do Sul. Pesquisa Agropecuária Brasileira, v. 45, n. 4, p. 339-347, 2010. Disponível em: https://www.redalyc.org/pdf/3052/305226701011.pdf. Acesso em: 29 jun. 2025.
ANDRIOLI, K. G.; SENTELHAS, P. C. Brazilian maize genotypes sensitivity to water deficit estimated through a simple crop yield model. Pesquisa Agropecuária Brasileira, v. 44, n. 7, p. 653-660, 2009. Disponível em: https://ainfo.cnptia.embrapa.br/digital/bitstream/item/38079/1/44n07a01.pdf. Acesso em: 29 jun. 2025.
ARAÚJO, G. G. L. et al. Adubação nitrogenada na cultura do milho. Revista Verde de Agroecologia e Desenvolvimento Sustentável, v. 7, n. 5, p. 132-138, 2012. Disponível em: https://www.arcjournals.org/pdfs/ijrsas/v7-i7/3.pdf. Acesso em: 29 jun. 2025.
BARTELS, D.; SUNKAR, R. Drought and salt tolerance in plants. Critical Reviews in Plant Sciences, v. 24, n. 1, p. 23-58, 2005. DOI: 10.1080/07352680590910410. Disponível em: https://pubmed.ncbi.nlm.nih.gov/15544344/. Acesso em: 29 jun. 2025.
BHARTI, P. et al. Impacts of salinity stress on crop plants: improving salt tolerance through genetic and molecular dissection. Frontiers in Plant Science, v. 14, p. 1241736, 2023. DOI: 10.3389/fpls.2023.1241736. Disponível em: https://www.frontiersin.org/articles/10.3389/fpls.2023.1241736/full. Acesso em: 29 jun. 2025.
BIANCHI, V. J. et al. Morpho-physiological responses and osmotic adjustment of pistachio rootstocks under drought stress. Scientia Agricola, v. 73, n. 5, p. 450-457, 2016. DOI: 10.1590/0103-9016-2015-0294. Disponível em: https://www.scielo.br/j/sa/a/G3mSpjw9CCqjhb9BxtnPKjm/?lang=en. Acesso em: 29 jun. 2025.
BLUM, A. Osmotic adjustment is a prime drought stress adaptive engine in support of plant production. Plant, Cell & Environment, v. 40, n. 1, p. 4-10, 2017. DOI: 10.1111/pce.12800. Disponível em: https://pubmed.ncbi.nlm.nih.gov/27417527/. Acesso em: 29 jun. 2025.
BRODRIBB, T. J.; MCADAM, S. A. M. Evolution of the Stomatal Regulation of Plant Water Content. Plant Physiology, v. 174, n. 2, p. 639-649, 2017. DOI: 10.1104/pp.17.00078. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC5462025/. Acesso em: 29 jun. 2025.
CHEN, T. H.; MURATA, N. Enhancement of tolerance of abiotic stress by metabolic engineering of betaines and other compatible solutes. Current Opinion in Plant Biology, v. 5, n. 3, p. 250-257, 2002. DOI: 10.1046/j.1365-3040.2002.00782.x. Disponível em: https://onlinelibrary.wiley.com/doi/full/10.1046/j.1365-3040.2002.00782.x. Acesso em: 29 jun. 2025.
CUSHMAN, J. C. Osmoregulation in Plants: Implications for Agriculture. American Zoologist, v. 41, p. 758-769, 2001. Disponível em: https://www.esalq.usp.br/lepse/imgs/conteudo_thumb/mini/Osmoregulation-in-Plants-Implications-for-Agriculture1.pdf. Acesso em: 29 jun. 2025.
DA SILVA, J. A. T. et al. Acclimation of Coffea canephora to drought and heat: physiological, biochemical, and molecular responses. Frontiers in Plant Science, v. 13, p. 792079, 2022. DOI: 10.3389/fpls.2022.792079. Disponível em: https://www.frontiersin.org/articles/10.3389/fpls.2022.792079/full. Acesso em: 29 jun. 2025.
DA SILVA, J. A. T. et al. Mechanisms involved in mitigating drought in coffee. Ecofriendly Coffee, 2024. Disponível em: https://ecofriendlycoffee.org/mechanisms-involved-in-mitigating-drought-in-coffee/. Acesso em: 29 jun. 2025.
DENG, Y. et al. Genome-wide association study identifies novel loci and candidate genes for salt tolerance during soybean germination. BMC Plant Biology, v. 25, p. 396, 2025. DOI: 10.1186/s12870-025-06583-x. Disponível em: https://bmcplantbiol.biomedcentral.com/articles/10.1186/s12870-025-06583-x. Acesso em: 29 jun. 2025.
DESHMUKH, R.; SONAH, H.; BELANGER, R. R.; M. R. P. Jasmonates in plant tolerance to abiotic and biotic stresses. In: HOSSAIN, M. A. et al. (ed.). Plant-environment interaction: responses and approaches to mitigate stress. Cham: Springer, 2019. p. 1-22. DOI: 10.1007/978-3-319-28899-4_5. Disponível em: http://link.springer.com/10.1007/978-3-319-28899-4_5. Acesso em: 29 jun. 2025.
DIAS, M. C.; PINTO, G.; CORREIA, C. Plant acclimation to osmotic stress. In: Drought stress tolerance in plants. Cham: Springer, 2023. DOI: 10.1007/s12633-023-02826-4. Disponível em: https://link.springer.com/10.1007/s12633-023-02826-4. Acesso em: 29 jun. 2025.
DURAN, C. et al. Melatonin and its metabolites improve tomato (Solanum lycopersicum L.) tolerance to combined drought and heat stress. Antioxidants, v. 13, n. 1, p. 55, 2024. DOI: 10.3390/antiox13010055. Disponível em: https://www.mdpi.com/2076-3921/13/1/55. Acesso em: 29 jun. 2025.
ECOHYDROL, W. et al. Understanding and managing soil water dynamics in a changing climate. Ecohydrology, v. 15, p. 2386, 2022. Disponível em: https://ui.adsabs.harvard.edu/abs/2022Ecohy..15E2386W/abstract. Acesso em: 29 jun. 2025.
FANG, S. et al. Potassium application enhances drought tolerance in sesame by mitigating oxidative damage and regulating osmotic adjustment. Frontiers in Plant Science, v. 13, p. 1096606, 2022. DOI: 10.3389/fpls.2022.1096606. Disponível em: https://www.frontiersin.org/articles/10.3389/fpls.2022.1096606/full. Acesso em: 29 jun. 2025.
FAZELI, F.; GHESHM, M.; NADERI, M. Osmotic adjustment in wheat cultivars under drought stress. Journal of Food, Agriculture & Environment, v. 5, n. 3&4, p. 253-256, 2007. Disponível em: https://www.semanticscholar.org/paper/f9b277eb7914cefe86a9d75adce3e736ee3d3a4f. Acesso em: 29 jun. 2-25.
FERRAZ, R. L. S. et al. Growth, gas exchange and chlorophyll a fluorescence in onion cultivars submitted to water deficit. Horticultura Brasileira, v. 30, p. 586-590, 2012. Disponível em: https://www.scirp.org/journal/PaperDownload.aspx?paperID=63598. Acesso em: 29 jun. 2025.
FERREIRA-SILVA, S. L. et al. Water relations and gas exchange in cashew plants under salt stress. Revista Ciência Agronômica, v. 41, n. 3, p. 329-335, 2010. DOI: 10.1016/S0098-8472(10)00117-6. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0098847210001176. Acesso em: 29 jun. 2025.
FIGUEIREDO, F. A. M. M. A. et al. Drought-tolerant soybean development: evaluation of GM lines under greenhouse conditions. Embrapa Soja, 2020. Disponível em: https://www.alice.cnptia.embrapa.br/alice/bitstream/doc/1128419/1/Drought-tolerant-soybean-development-evaluation-of-GM-lines-under.pdf. Acesso em: 29 jun. 2025.
GHOLAMI, S. et al. The effect of different levels of drought stress on germination and early seedling growth of forage oat genotypes. Acta Scientific Agriculture, v. 6, n. 7, p. 1-8, 2022. Disponível em: https://actascientific.com/ASAG/pdf/ASAG-06-1179.pdf. Acesso em: 29 jun. 2025.
GRATTAN, S. R.; GRIEVE, C. M. Mineral nutrient acquisition and assimilation by plants in saline and sodic environments. In: Pessarakli, M. (ed.). Handbook of plant and crop stress. 2. ed. New York: Marcel Dekker, 1999. p. 203-226. Disponível em: https://www.semanticscholar.org/paper/36d3d5c35163408e4371c1847f38e47a545494ac. Acesso em: 29 jun. 2025.
GUO, Z. et al. Glycine betaine alleviates salt stress in tomato seedlings by regulating ion homeostasis, antioxidant defense, and polyamine metabolism. Frontiers in Plant Science, v. 13, p. 1080504, 2023. DOI: 10.3389/fpls.2023.1080504. Disponível em: https://www.frontiersin.org/articles/10.3389/fpls.2023.1080504/full. Acesso em: 29 jun. 2025.
GUPTA, B.; HUANG, B. Mechanism of salinity tolerance in plants: physiological, biochemical, and molecular characterization. International Journal of Genomics, v. 2014, p. 701596, 2014. DOI: 10.1155/2014/701596. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC3608781/. Acesso em: 29 jun. 2025.
HANNEMAN, A. N. Ultimate guide to turgor pressure and plant water relations. Number Analytics, 2022. Disponível em: https://www.numberanalytics.com/blog/ultimate-guide-turgor-pressure-plant-water-relations. Acesso em: 29 jun. 2025.
HANNEMAN, A. N. Understanding glycine betaine as an osmolyte in microbial physiology. Number Analytics, 2023. Disponível em: https://www.numberanalytics.com/blog/glycine-betaine-osmolyte-microbial-physiology. Acesso em: 29 jun. 2025.
HE, Y. et al. Physiological and transcriptomic analyses reveal the mechanisms of melatonin in enhancing the drought tolerance of soybean seedlings. BMC Plant Biology, v. 24, p. 698, 2024. DOI: 10.1186/s12870-024-05459-x. Disponível em: https://link.springer.com/10.1007/s11738-023-03583-y. Acesso em: 29 jun. 2025.
HESSINI, K. et al. Proline application enhances the drought stress tolerance in Cakile maritima. Plant Cell Biotechnology and Molecular Biology, v. 25, n. 25-26, p. 1-14, 2024. Disponível em: https://ikprress.org/index.php/PCBMB/article/view/9303. Acesso em: 29 jun. 2025.
HOFFMANN, W. A. et al. Fire and drought: soluble carbohydrate storage and resprouting of savanna plants. BioScience, v. 66, n. 2, p. 107-116, 2016. DOI: 10.1093/bioscience/biv166. Disponível em: http://academic.oup.com/bioscience/article/66/2/107/2468681/Fire-and-Drought-Soluble-Carbohydrate-Storage-and. Acesso em: 29 jun. 2025.
KHAN, M. N. et al. Role of plant growth regulators in plant adaptation to abiotic stresses. Plant Growth Regulation, v. 98, p. 297-314, 2022. DOI: 10.1007/s00709-022-01753-2. Disponível em: https://link.springer.com/10.1007/s00709-022-01753-2. Acesso em: 29 jun. 2025.
KIM, T. H. et al. Guard cell signal transduction network: a systems-level perspective. Annual Review of Plant Biology, v. 59, p. 595-620, 2008. DOI: 10.1146/annurev.arplant.59.032607.092734. Disponível em: https://www.annualreviews.org/content/journals/10.1146/annurev.arplant.59.032607.092734. Acesso em: 29 jun. 2025.
KOUTROUBAS, S. D.; DAMALAS, C. A. Proline and glycine betaine in plants: biosynthesis, metabolism, and functions. Plants, v. 12, n. 13, p. 2577, 2023. DOI: 10.3390/plants12132577. Disponível em: https://link.springer.com/10.1007/s12033-024-01351-y. Acesso em: 29 jun. 2025.
KUMAR, A. et al. Current understanding of osmoregulation and its implications for crop improvement under drought stress. Frontiers in Plant Science, v. 15, p. 1382914, 2024. DOI: 10.3389/fpls.2024.1382914. Disponível em: https://www.frontiersin.org/articles/10.3389/fpls.2024.1382914/full. Acesso em: 29 jun. 2025.
LEPROT, [canal]. Osmoregulation in Plants. [S. l.: s. n.], 2022. 1 vídeo (4 min). Disponível em: https://www.youtube.com/watch?v=_-018H2QgRk. Acesso em: 29 jun. 2025.
LI, W. et al. Expression of a wheat vacuolar Na+/H+ antiporter gene (TaNHX2) in transgenic tobacco enhances tolerance to salt stress. Plant Science, v. 180, n. 4, p. 572-578, 2011. DOI: 10.1016/j.plantsci.2010.12.012. Disponível em: https://www.semanticscholar.org/paper/89b04e2a0e45ce0b52b30ad30771537fca04cb54. Acesso em: 29 jun. 2025.
LIN, S. et al. Physiological Regulation of Photosynthetic-Related Indices, Antioxidant Defense, and Proline Anabolism on Drought Tolerance of Wild Soybean (Glycine soja L.). Plants, v. 13, n. 6, p. 880, 2024. DOI: 10.3390/plants13060880. Disponível em: https://www.mdpi.com/2223-7747/13/6/880. Acesso em: 29 jun. 2025.
LIU, J. et al. Plant aquaporins: multifunctional water channels. The Plant Cell, v. 28, n. 8, p. 1769-1782, 2016. DOI: 10.1105/tpc.16.00282. Disponível em: https://academic.oup.com/plcell/article/28/8/1769-1782/6100899. Acesso em: 29 jun. 2025.
MA, Q. et al. Osmotic adjustment and its contribution to drought tolerance in plants: a review. Environmental and Experimental Botany, v. 177, p. 104113, 2020. DOI: 10.3389/fpls.2020.00553. Disponível em: https://www.frontiersin.org/article/10.3389/fpls.2020.00553/full. Acesso em: 29 jun. 2025.
MARTINS, J. D. L. et al. Agronomic performance and water use efficiency in soybean cultivars under different irrigation depths. Journal of Agronomy Science, v. 10, p. 1-12, 2024. DOI: 10.34188/bjaerv10n1-001. Disponível em: https://ccsenet.org/journal/index.php/jas/article/view/0/48368. Acesso em: 29 jun. 2025.
MICKKY, B. M. Glycine betaine as a multifaceted metabolite in plants. Plants, v. 11, n. 4, p. 559, 2022. DOI: 10.3390/plants11040559. Disponível em: https://www.mdpi.com/2223-7747/11/4/559/pdf. Acesso em: 29 jun. 2025.
MIYAZAKI, S. et al. Drought adaptation and developmentsmall-scale irrigated agriculture in Northeast Brazil. Inter-American Institute for Global Change Research, 2017. Disponível em: https://www.iai.int/en/article/detail/drought-adaptation-and-developmentsmall-scale-irrigated-agriculture-in-northeast-brazil. Acesso em: 29 jun. 2025.
MUNNS, R. Comparative physiology of salt and water stress. Plant, Cell & Environment, v. 25, n. 2, p. 239-250, 2002. DOI: 10.1046/j.0016-8025.2001.00808.x. Disponível em: https://www.periodicos.capes.gov.br/index.php/acervo/buscador.html?task=detalhes&id=W2327007488. Acesso em: 29 jun. 2025.
MUNNS, R.; TESTER, M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, v. 59, p. 651-681, 2008. DOI: 10.1146/annurev.arplant.59.032607.092911. Disponível em: https://www.semanticscholar.org/paper/f9b277eb7914cefe86a9d75adce3e736ee3d3a4f. Acesso em: 29 jun. 2025.
NELSON, D. E. et al. Plant salt tolerance. Trends in Plant Science, v. 3, n. 2, p. 61-65, 1998. DOI: 10.1007/s42729-020-00198-x. Disponível em: http://link.springer.com/10.1007/s42729-020-00198-x. Acesso em: 29 jun. 2025.
NEPOMUCENO, A. L. et al. Tolerância à seca em soja: aspectos fisiológicos e genético-moleculares. Embrapa Soja, 2016. Disponível em: https://www.alice.cnptia.embrapa.br/alice/bitstream/doc/1054363/1/cirtec125.pdf. Acesso em: 29 jun. 2025.
NGUYEN, G. N. et al. Roles of aquaporins in plant stress responses. Journal of Experimental Botany, v. 68, n. 13, p. 3367-3375, 2017. DOI: 10.1093/jxb/erx201. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28922767/. Acesso em: 29 jun. 2025.
NUNES, A. B. A. et al. Aclimatação de mudas de Anadenanthera colubrina a diferentes condições hídricas. Revista Caatinga, v. 27, n. 4, p. 29-37, 2014. Disponível em: https://www.researchgate.net/publication/280735398_Acclimatization_of_Anadenanthera_colubrina_var_cebil_Griseb_Altschul_seedlings_to_different_water_conditions. Acesso em: 29 jun. 2025.
OLIVEIRA, J. F. Análise da viabilidade econômica da substituição de motores elétricos de uma indústria de embalagens plásticas. In: ENCONTRO NACIONAL DE ENGENHARIA DE PRODUÇÃO, 38., 2018, Maceió. Anais… Maceió: ABEPRO, 2018. Disponível em: http://www.abepro.org.br/publicacoes/artigo.asp?e=enegep&a=2018&c=36549. Acesso em: 29 jun. 2025.
OZTURK, M. et al. Osmoregulation and its actions during the drought stress in plants. Physiologia Plantarum, v. 172, n. 2, p. 1321-1335, 2021. DOI: 10.1111/ppl.13297. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33280137/. Acesso em: 29 jun. 2025.
PARIDA, A. K.; DAS, A. B. Salt tolerance and salinity effects on plants: a review. Ecotoxicology and Environmental Safety, v. 60, n. 3, p. 324-349, 2005. DOI: 10.1016/j.ecoenv.2004.06.010. Disponível em: https://pubmed.ncbi.nlm.nih.gov/14965946/. Acesso em: 29 jun. 2025.
PEREIRA, J. S.; CHAVES, M. M.; CALDEIRA, M. C.; CORREIA, A. V. Plant responses to drought. In: PESSARAKLI, M. (ed.). Handbook of plant and crop stress. 2. ed. New York: Marcel Dekker, 1999. p. 401-424. Disponível em: https://www.periodicos.capes.gov.br/index.php/acervo/buscador.html?task=detalhes&id=W2327007488. Acesso em: 29 jun. 2025.
PINHEIRO, C.; CHAVES, M. M. Photosynthesis and drought: can we make metabolic connections from available data?. Journal of Experimental Botany, v. 62, n. 3, p. 869-882, 2011. DOI: 10.1093/jxb/erq444. Disponível em: https://academic.oup.com/jxb/article/62/3/869/547537. Acesso em: 29 jun. 2025.
QIU, S. et al. Comprehensive metabolomic and transcriptomic analyses reveal the mechanism of salt tolerance in Carex duriuscula. Frontiers in Plant Science, v. 13, p. 1015317, 2022. DOI: 10.3389/fpls.2022.1015317. Disponível em: https://www.frontiersin.org/articles/10.3389/fpls.2022.1015317/full. Acesso em: 29 jun. 2025.
REDDY, A. R. et al. Physiology and molecular biology of salinity stress tolerance in plants. Current Science, v. 86, n. 11, p. 1520-1531, 2004. Disponível em: https://www.researchgate.net/publication/237553835_Physiology_and_molecular_biology_of_salinity_stress_tolerance_in_plants. Acesso em: 29 jun. 2025.
RIOS, G. F.; GURGEL, M. T.; ALVES, E. U. Condicionamento osmótico em sementes de Leucaena leucocephala. Ciência Rural, v. 42, n. 1, p. 55-61, 2012. Disponível em: https://www.scielo.br/j/babt/a/skdT3cZPwRqF4kQvSv58WjL/. Acesso em: 29 jun. 2025.
SAIRAM, R. K.; TYAGI, A. Physiology and molecular biology of salinity tolerance in plants. Current Science, v. 86, n. 3, p. 407-421, 2004. Disponível em: https://www.jstor.org/stable/24108870. Acesso em: 29 jun. 2025.
SÁNCHEZ-REUS, M. I. et al. Osmotic stress in plants. In: Plant physiological aspects of abiotic stress. [S. l.]: IntechOpen, 2023. DOI: 10.5772/intechopen.1002773. Disponível em: https://digital.csic.es/bitstream/10261/335085/1/2023_OsmoticStress.pdf. Acesso em: 29 jun. 2025.
SANTOS, C. V. Regulation of chlorophyll biosynthesis and degradation by salt stress in sunflower leaf discs. Journal of Plant Physiology, v. 161, n. 2, p. 215-221, 2004. DOI: 10.1078/0176-1617-01036. Disponível em: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=4045823. Acesso em: 29 jun. 2025.
SANTOS, T. O. et al. Salinity effects on growth, gas exchange and nutrient status in Jatropha curcas L. Pakistan Journal of Botany, v. 53, n. 2, p. 553-560, 2021. Disponível em: https://www.pakbs.org/pjbot/papers/1678865192.pdf. Acesso em: 29 jun. 2025.
SCHWACKE, R. et al. A novel, multifunctional transporter from Lycopersicon esculentum (LeProT1) provides tolerance to high salinity and water deficit. The Plant Journal, v. 36, n. 6, p. 777-789, 2003. Disponível em: http://www.esalq.usp.br/lepse/imgs/conteudo_thumb/LeProT1–a-Transporter-for-Proline–Glycine-Betaine–and-y-Amino-Butyric-Acid.pdf. Acesso em: 29 jun. 2025.
SHARMA, P.; DUBEY, R. S. Drought induces oxidative stress and enhances the activities of antioxidant enzymes in growing rice seedlings. Plant Growth Regulation, v. 46, p. 209-221, 2005. DOI: 10.1007/s10725-005-7206-8. Disponível em: http://link.springer.com/10.1007/s11105-015-0884-8. Acesso em: 29 jun. 2025.
SHARMA, S.; VILLAMOR, J. G.; VERSLUES, P. E. Essential role of tissue-specific proline synthesis and catabolism in growth and drought tolerance. Molecular Plant, v. 4, n. 6, p. 1032-1046, 2011. DOI: 10.1093/mp/ssr051. Disponível em: https://www.frontiersin.org/journals/plant-science/articles/10.3389/fpls.2015.00484/full. Acesso em: 29 jun. 2025.
SIJTSMA, R. How biostimulants can help crops withstand drought and heat conditions. Greenhouse Grower, 2023. Disponível em: https://www.greenhousegrower.com/production/how-biostimulants-can-help-crops-withstand-drought-and-heat-conditions/. Acesso em: 29 jun. 2025.
SILVA, C. J. et al. Water use efficiency and yield of common bean cultivars in response to water deficit. Journal of Agronomy and Crop Science, v. 201, p. 147-154, 2015. DOI: 10.1111/jac.12097. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26336033/. Acesso em: 29 jun. 2025.
SINGH, M.; SINGH, D.; KUMAR, A. Osmotic stress signaling and tolerance in plants. Plant Gene, v. 35, p. 100434, 2023. DOI: 10.1016/j.plgene.2023.100434. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0981942823002152. Acesso em: 29 jun. 2025.
TANG, J. et al. Transcriptional and physiological analyses of Arabidopsis thaliana response to salt stress. Plants, v. 9, n. 5, p. 560, 2020. DOI: 10.3390/plants9050560. Disponível em: https://www.mdpi.com/2223-7747/9/5/560. Acesso em: 29 jun. 2025.
TORRES FILHO, J. Necessidades hídricas, desenvolvimento e análise econômica da cultura do milho nas condições do semiárido brasileiro. 2014. Dissertação (Mestrado) – Universidade Federal Rural do Semi-Árido. Disponível em: https://repositorio.ufersa.edu.br/handle/tede/496. Acesso em: 29 jun. 2025.
VERSLUES, P. E.; SHARMA, S. Proline metabolism and its implications for plant-environment interaction. The Arabidopsis Book, v. 8, p. e0140, 2010. DOI: 10.1199/tab.0140. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC8397809/. Acesso em: 29 jun. 2025.
XIAO, C. et al. Water-Percept: an innovative solution for water stress management in agriculture. INESC TEC, 2023. Disponível em: https://www.inesctec.pt/en/technologies/water-percept. Acesso em: 29 jun. 2025.
YANG, S. et al. Physiological and molecular mechanisms of plant salt tolerance. Frontiers in Plant Science, v. 14, p. 1118313, 2023. DOI: 10.3389/fpls.2023.1118313. Disponível em: https://www.frontiersin.org/articles/10.3389/fpls.2023.1118313/full. Acesso em: 29 jun. 2025.
YIN, D. et al. Integrative transcriptomic and metabolomic analyses reveal the mechanisms underlying the promotion of salt tolerance in rice by Bacillus velezensis. Nature Scientific Reports, v. 13, p. 13866, 2023. DOI: 10.1038/s41598-023-40694-5. Disponível em: https://www.nature.com/articles/s41598-023-40694-5. Acesso em: 29 jun. 2025.
ZHU, J.-K. Plant salt tolerance. Trends in Plant Science, v. 6, n. 2, p. 66-71, 2001. DOI: 10.1016/S1360-1385(00)01838-0. Disponível em: https://www.cell.com/trends/plant-science/fulltext/S1360-1385(00)01838-0. Acesso em: 29 jun. 2025.
ZHU, J.-K. Salt and drought stress signal transduction in plants. Annual Review of Plant Biology, v. 53, p. 247-273, 2002. DOI: 10.1146/annurev.arplant.53.091401.143329. Disponível em: https://www.annualreviews.org/doi/10.1146/annurev.arplant.53.091401.143329. Acesso em: 29 jun. 2025.
ZORNOZA, C.; HERNÁNDEZ, A. Plant responses to salinity. In: Plant responses to abiotic stress. [S. l.]: IntechOpen, 2024. DOI: 10.5772/intechopen.1003445. Disponível em: https://www.frontiersin.org/articles/10.3389/fpls.2024.1352465/full. Acesso em: 29 jun. 2025.





0 comentários